フェレット,ネコ,イヌおよび他の家畜のSARS-コロナウイルス2に対する感受性
今回は
フェレット,ネコ,イヌおよび他の家畜のSARS-コロナウイルス2に対する感受性
について報告したサイエンスの論文について説明したいとおもいます.
本文の中にある数字はリファレンス論文の番号ですので,気になる方は元論文をお読みください.
science.sciencemag.org/content/368/6494/1016
抄録
重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)は,2019年12月に中国のウハンで初めて報告された感染症COVID-19を引き起こす.
この疾患を制御するための多大な努力にもかかわらず,COVID-19は現在100カ国以上に広がり,世界的なパンデミックを引き起こしている.
SARS-CoV-2はコウモリに由来すると考えられているが,このウイルスの中間動物源は全く不明である.
本稿では,ヒトと密接に接触したフェレットおよび動物のSARS-CoV-2に対する感受性を検討した.
SARS-CoV-2はイヌ,豚,ニワトリ,アヒルでは複製が不良であるが,フェレットやネコは感染に対する感受性があることがわかった.
著者らは,ネコが空気感染に感受性であることを実験的に見出した.
本研究は,SARS-CoV-2の動物モデルおよびCOVID-19制御のための動物管理に関する重要な洞察を提供する.
本文
2019年12月下旬,中国のWuhanでヒトに異常な肺炎が出現し,急速に国際的に広がり,世界的な公衆衛生の懸念が高まった.
原因病原体は,ウイルス分類に関する国際委員会のコロナウイルス研究グループ(17)による関連コロナウイルスの系統発生分析に基づいて,重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と命名された新規コロナウイルス(1-16)として同定された;その原因となる疾患は,その後,世界保健機関(WHO)によってCOVID-19と命名された.
COVID-19のアウトブレイクを抑制するための多大な努力にもかかわらず,この疾患は依然として広がっている.
2020年3月11日現在,100カ国以上でSARS-CoV-2感染症が報告され,118,326例のヒト症例が確認され,4,292例(18例)が死亡している.
COVID-19は現在,WHOからパンデミックとして発表されている.
SARS-CoV-2はコロナウイルスRaTG13とヌクレオチドレベルで96.2%の同一性を共有しているが,2013年(3)に雲南省の馬蹄コウモリ(Rhinolophus spp)で検出されたが,これまでヒトまたは他の動物では検出されていない.
新たな状況は,多くの緊急の疑問を提起する.
広範に播種されたウイルスは他の動物種に伝播し,その後,どのウイルスが感染の保有宿主となるのだろうか.
SARS-CoV-2感染は,軽度の感染から死亡まで,ヒトにおいて広範な臨床スペクトルを有するが,ウイルスは他の動物においてどのように振る舞うのだろうか.
ワクチンや抗ウイルス薬の開発に努力が払われるにつれて,ヒトにおけるこのような制御手段の有効性をモデル化するために最も正確に使用できる動物はどれか.
これらの疑問に対処するため,異なるモデル実験動物,ならびにコンパニオンおよび家畜のSARS-CoV-2に対する感受性を評価した.
感染性SARS-CoV-2によるすべての実験は,中国農務省および農村省によりそのような使用が承認された中国農業科学アカデミー(CAAS)のHarbin Veterinary Research Institute (HVRI)のバイオセーフティレベル4および動物バイオセーフティレベル4の施設で実施された.
実施されたバイオセーフティおよびバイオセキュリティ対策の詳細は,補足資料(19)に記載されている.
動物実験及び動物福祉に関する実施計画書は,CAASのHVRIの動物実験の倫理に関する委員会(承認番号2020-01-01JiPi)において審査され,承認された.
フェレット
フェレットは,ヒトに感染した呼吸器ウイルスの動物モデルとして一般的に使用されている(20-26).
したがって,フェレットにおけるSARS-CoV-2の影響度をテストした.
本研究では2種類のウイルス(Wuhanの海鮮市場(F13-E)で採取した環境試料から分離したSARS-CoV-2/F13/環境/2020/Wuhan,およびヒト患者から分離したSARS-CoV-2/CTan/human/2020/Wuhan (CTan-H))を用いた.
フェレットのペアにそれぞれF13-EまたはCTan-Hの105プラーク形成単位(PFU)を鼻腔内接種し,接種後4日目(p.i.)に安楽死させた.
各フェレットから鼻甲介,軟口蓋,扁桃,気管,肺,心臓,肝臓,脾臓,腎臓,膵臓,小腸,脳を採取し,qPCR法によるウイルスRNA定量とVero E6細胞におけるウイルス滴定を行った.
ウイルスRNA (図1,AおよびB)および感染性ウイルスは,これら2種類のウイルスを接種した4匹のフェレットすべての鼻甲介,軟口蓋,扁桃で検出されたが,検査した他の臓器では検出されなかった(図1,CおよびD).
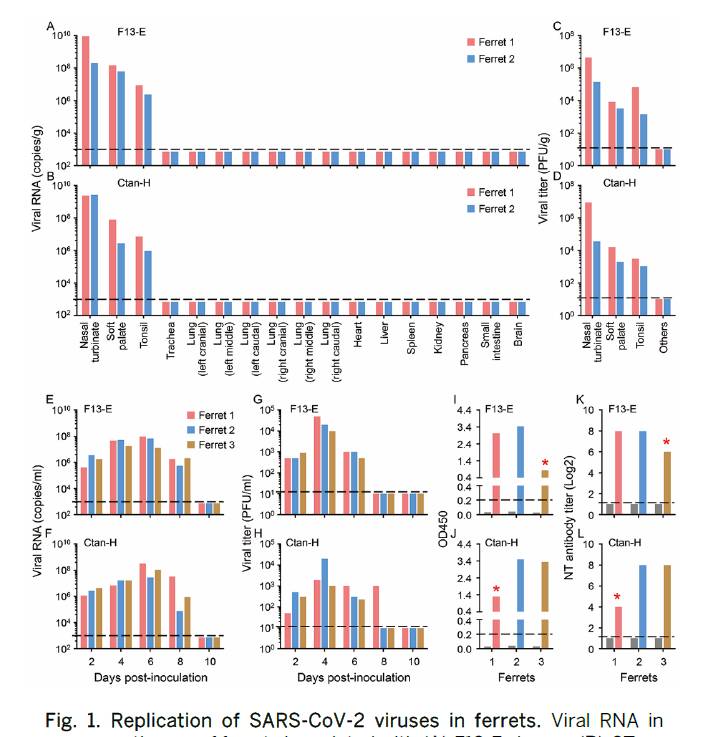
これらの結果は,SARS-CoV-2がフェレットの上気道で複製できるが,他の器官でのその複製は検出できないことを示す.
フェレットにおけるこれらのウイルスの複製動態を調べるために,3匹の動物群に105 PFUのF13-EまたはCTan-Hを鼻腔内接種し,その後,アイソレーター内の3つの別々のケージに入れた.
フェレットから感染後2,4,6,8,10日目に鼻腔洗浄液および直腸スワブを採取し,ウイルスRNA検出およびウイルス滴定を行った.
体温と疾患の徴候を2週間モニターした.
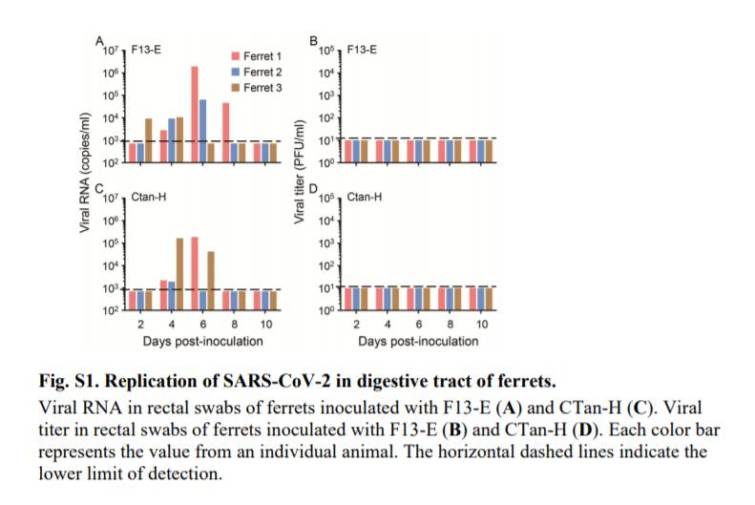
図1に示すように,2種類のウイルスを接種したフェレット6匹すべてにおいて,感染後2,4,6,8日目の鼻腔洗浄液からウイルスRNAが検出され(図1,E,F),ウイルス接種フェレットの直腸スワブの一部からもウイルスRNAが検出されたが,これらのフェレットの鼻腔洗浄液よりもコピー数は顕著に少なかった(図1,A,C).
すべてのフェレット(図1,GおよびH)の鼻腔洗浄液から感染性ウイルスが検出されたが,いずれのフェレット(図S1,BおよびD)の直腸スワブからは検出されなかった.
各ウイルス接種群の1頭のフェレットは,感染後10日目および12日目にそれぞれ発熱および食欲不振を発現した.
これらの症状が下気道でのウイルス複製によって引き起こされたかどうかを調べるために,感染後13日目に2匹のフェレットを安楽死させ,ウイルスRNA検出のためにそれらの器官を採取した.
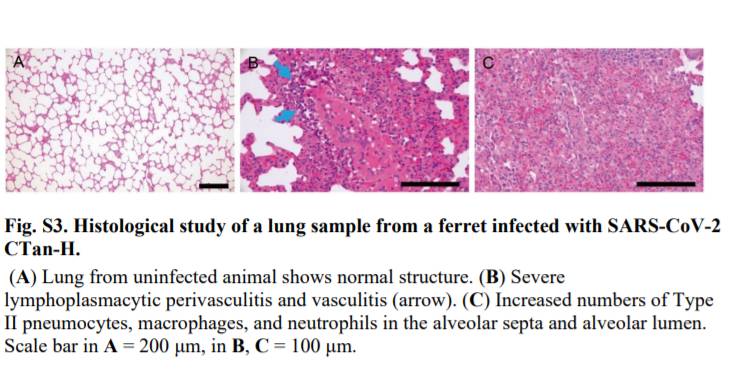
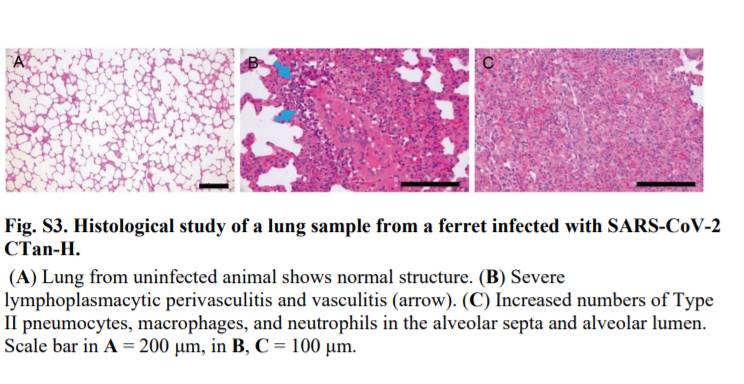
しかしながら,CTan-Hを接種したフェレットの鼻甲介における低コピー数(105.4コピー/g)を除き(図S2),いずれのフェレットの他の組織または臓器においてもウイルスRNAは検出されなかった.病理学的研究では,重度のリンパ形質細胞性血管周囲炎および血管炎,肺胞中隔および肺胞腔におけるII型肺細胞,マクロファージ,および好中球の数の増加,ならびにp.i.13日に安楽死させた2匹のフェレットの肺における軽度の気管支周囲炎が明らかとなった(図S3).
感染後13日目に安楽死させた2頭のフェレットの抗体価は感染後20日目に安楽死させたフェレットの抗体価よりも顕著に低かったが,SARS-CoV-2に対する抗体はELISA法および中和法によりすべてのフェレットで検出された(図1,I~L).
ウイルス付着アッセイにより,SARS-CoV-2がフェレット肺の細気管支上皮細胞(図S4A)および一部のII型肺細胞(図S4B)に付着しうることが示された.
フェレットの肺でSARS-CoV-2が複製するかどうかをさらに調べるために,フェレット8頭にCTan-Hの105 PFUを気管内接種し,感染後2,4,8,14日に各2頭ずつ安楽死させ,組織および臓器中のウイルスRNAを調べた.
p.i.2および4日に安楽死させた2匹のフェレットのうち1匹の鼻甲介および軟口蓋;1匹のフェレットの軟口蓋,p.i.8日に安楽死させたもう1匹のフェレットの鼻甲介,軟口蓋,扁桃,および気管においてのみウイルスRNAが検出され;p.i.14日に安楽死させた2匹のフェレットのいずれからも検出されなかった(図S5).
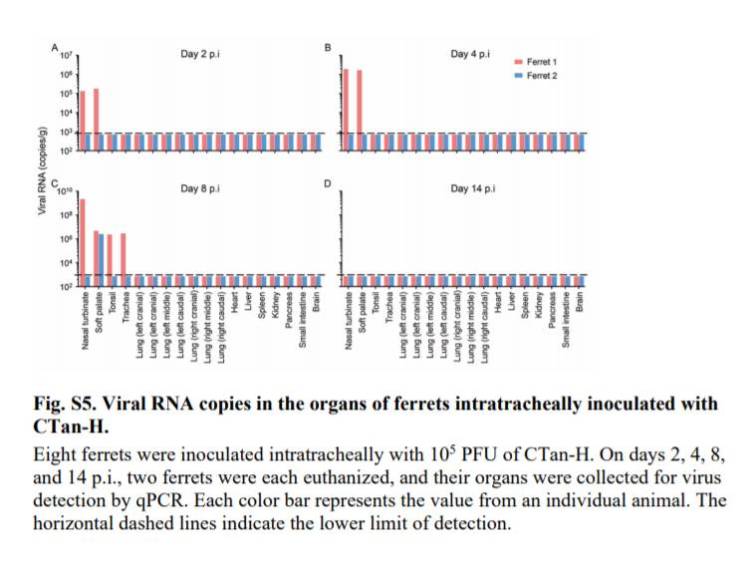
これらの結果は,SARS-CoV-2が重症病または死亡を引き起こすことなく,最大8日間フェレットの上気道で再現できることを示している.
ネコ,イヌ
ネコおよびイヌはヒトと密接に接触しているため,COVID-19制御のためにSARS-CoV-2に対する感受性を理解することが重要である.
まず,ネコにおけるSARS-CoV-2の複製を検討した.
亜成熟ネコ7頭(6~9か月齢,非近交系家ネコ)にCTan‐Hの105 PFUを鼻腔内接種した.
2匹をそれぞれp.i.3日およびp.i.6日に安楽死させ,その器官におけるウイルス複製を評価する予定であった.
3匹の亜成熟ネコをアイソレーター内に別々のケージに入れた.
呼吸液滴伝播をモニタリングするために,感染していないネコを各感染ネコに隣接したケージに入れた.
亜成熟ネコは攻撃的であったため,定期的な鼻洗浄採取を行うことは困難であった.
損傷の可能性を回避するために,これらのネコから糞便のみを採取し,安楽死後にその臓器中のウイルスRNAをチェックした.
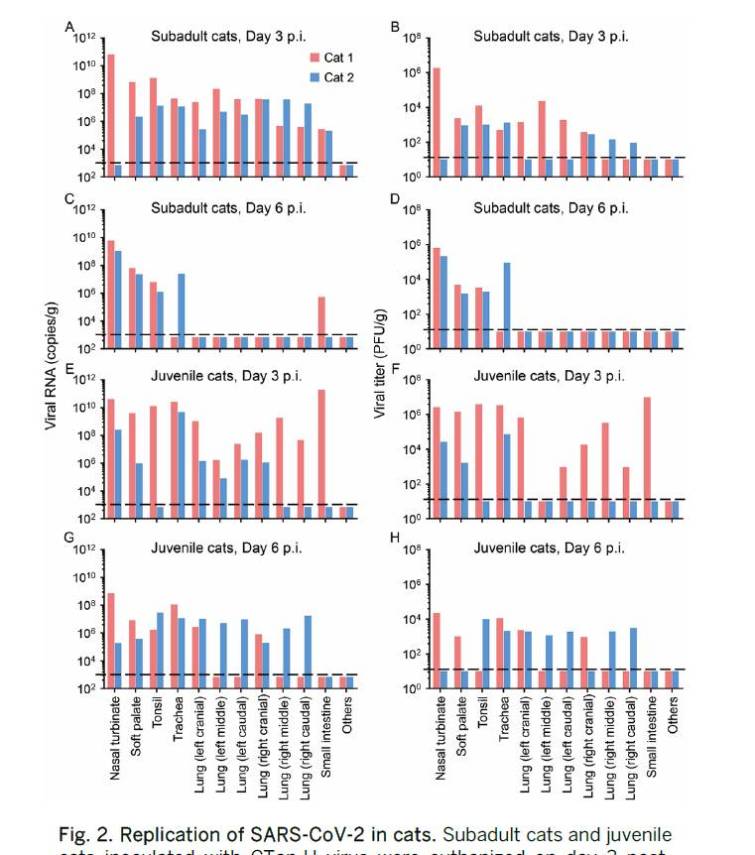
感染後3日目に安楽死させた両動物の軟口蓋,扁桃,気管,肺,小腸において,1匹の動物の鼻甲介からウイルスRNAが検出された(図2A).
感染後6日目に安楽死させた動物では,両動物の鼻甲介,軟口蓋,扁桃,一方の動物の気管,他方の動物の小腸にウイルスRNAが検出されたが,これらの動物のいずれの肺試料からもウイルスRNAは検出されなかった(図2C).
これらのネコのウイルスRNA陽性鼻甲介,軟口蓋,扁桃,気管,肺から感染性ウイルスが検出されたが,ウイルスRNA陽性小腸からは回収されなかった(図2,BおよびD)
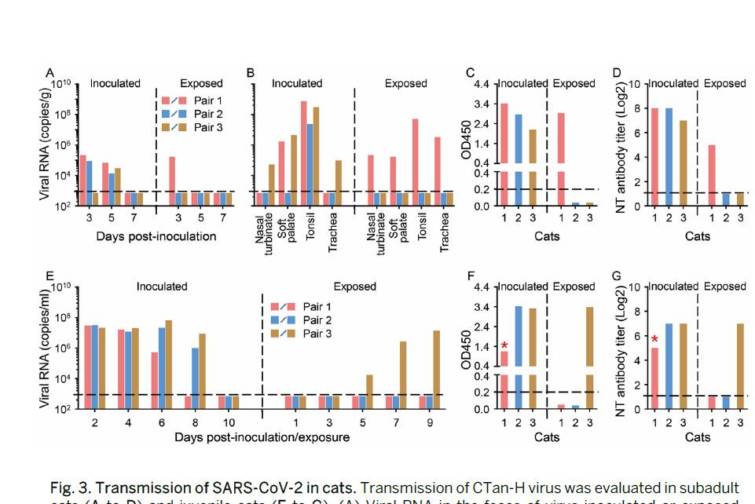
伝播試験では,感染後3日目に2匹のウイルス接種亜成熟ネコの糞便中にウイルスRNAが検出され,感染後5日目には3匹のウイルス接種亜成熟ネコすべてにウイルスRNAが検出された(図3A).
感染後3日目の曝露ネコ1匹の糞便からウイルスRNAが検出された(図3A).
ウイルスRNA陽性糞便を有する亜成熟ネコのペアを感染11日後に安楽死させ,ウイルス接種動物の軟口蓋および扁桃,ならびに暴露動物の鼻甲介,軟口蓋,扁桃,および気管にウイルスRNAが検出されたことから(図3B),このペアのネコに呼吸飛沫伝播が生じたことが示された.
感染後12日目に他のペアの動物を安楽死させた.ウイルスを接種した成ネコ1匹の扁桃腺,他のウイルスを接種した成ネコの鼻甲介,軟口蓋,扁桃,気管にウイルスRNAが検出されたが,暴露した成ネコ2匹の器官や組織には検出されなかった(図3B).
SARS-CoV-2に対する抗体は,ELISAおよび中和法を用いて,ウイルス接種した3匹の亜成熟ネコおよび1匹の暴露ネコのすべてで検出された(図3,CおよびD).
幼若ネコ(70~100日齢)を用いた複製・伝播試験(図2,E~H,3,E~G,図S6)を再現した.
感染後3日目に死亡または安楽死させたウイルス接種幼猫の検体について実施した病理組織学的検査では,鼻および気管粘膜上皮,肺に大きな病変が認められた(図S7).
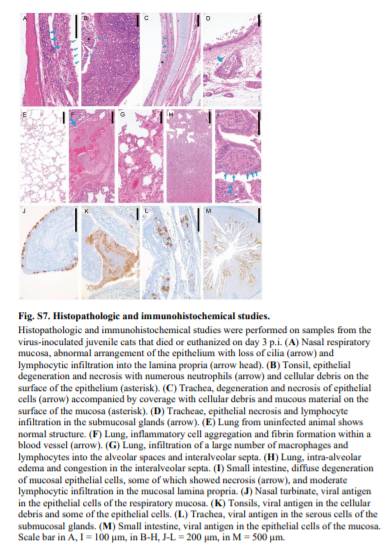
これらの結果は,SARS-CoV-2がネコにおいて効率的に複製可能であり,若齢のネコはより許容性があり,おそらくより重要なことに,このウイルスは空気感染経路を介してネコ間を伝播することができることを示している.
次に,イヌにおけるSARS-CoV-2の複製と伝播について検討した.
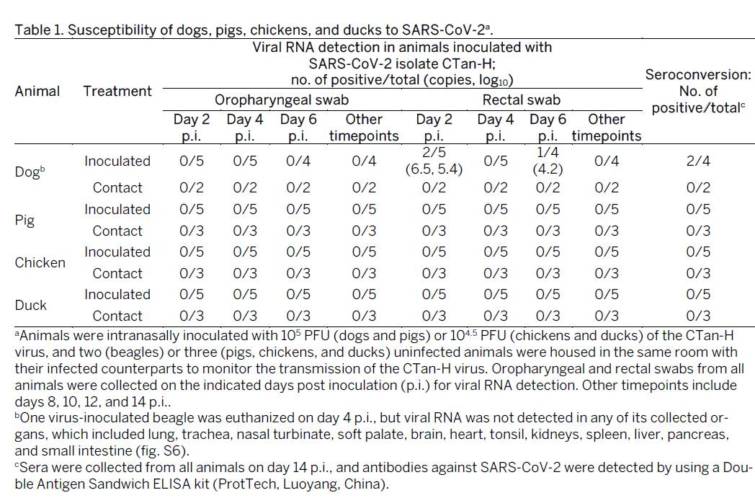
3か月齢のビーグル5匹にCTan‐Hの105 PFUを鼻腔内接種し,2匹の非接種ビーグルを室内に収容した.
各ビーグルから口腔咽頭および直腸スワブを感染後2,4,6,8,10,12および14日に採取し,Vero E6細胞におけるウイルスRNA検出およびウイルス滴定を行った.
感染後2日目に2頭のウイルス接種イヌの直腸スワブ,感染後6日目に1頭のイヌの直腸スワブからウイルスRNAが検出された(表1).
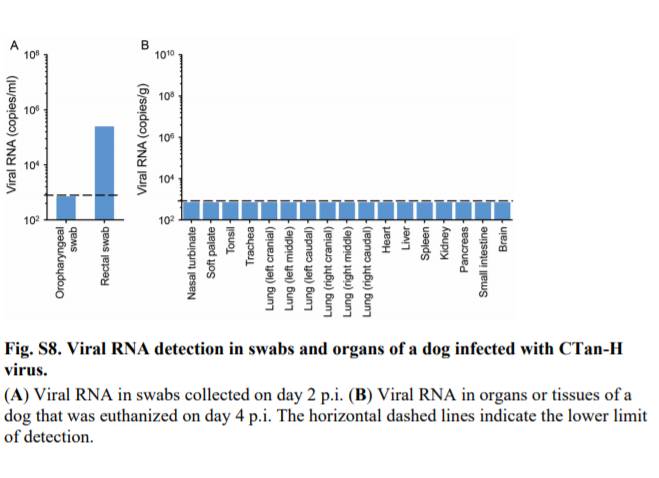
p.i.2日目の直腸スワブでウイルスRNA陽性であったイヌ1匹をp.i.4日目に安楽死させたが,このイヌから採取した臓器や組織ではウイルスRNAは検出されなかった(図S8).
これらのイヌから採取したスワブでは感染性ウイルスは検出されなかった.
ELISA法を用いて抗体検出のため,感染後14日目にすべてのイヌから血清を採取した.
2頭のウイルス接種イヌはセロコンバージョンした;他の2頭のウイルス接種イヌと2頭の接触イヌは,ELISA法(表1および図S9)に従い,すべてSARS-CoV-2に対して血清陰性であった.

これらの結果から,犬はSARS-CoV-2の影響を受けにくいことが分かった.
豚,ニワトリ,アヒル
また,豚,ニワトリ,アヒルのSARS-CoV-2に対する感受性をイヌの評価に用いたのと同じ戦略を用いて検討したが,これらのウイルス接種動物から採取したスワブや未感染の接触動物から採取したスワブではウイルスRNAは検出されず(表1),感染後14日目に採取した血清を用いたELISA法を用いて検査したところ,いずれの動物もSARS-CoV-2に対して血清陰性であった(表1).
これらの再溝は,豚,ニワトリ,アヒルがSARS-CoV-2に対して感受性がないことを示している.
要約すると,フェレットおよびネコはSARS-CoV-2に対して高い感受性を示し,イヌは低い感受性を示し,豚,ニワトリ,およびアヒルを含む家畜はウイルスに対して感受性がないことがわかった.
フェレットはヒト呼吸器ウイルスの研究のための動物モデルとして頻繁に使用されている(20~26).
フェレットの上気道と下気道の両方(20,22~24,26,27)でレプライクするインフルエンザウイルスや他のヒトSARS-コロナウイルスとは異なり,SARS-CoV-2はフェレットの鼻甲介,軟口蓋,扁桃でのみ複製することがわかった.
ウイルス感染フェレットの直腸スワブからウイルスRNAが検出されたため,消化管でも複製する可能性があるが,フェレットにウイルスを気管内接種した後でも,肺葉からウイルスは検出されなかった.
ヒト(13, 28)で観察されているように,このウイルスが雌のフェレットよりも雄のフェレットでより重度の疾患を引き起こすかどうかは依然として不明である.
SARS-CoV-2は,その受容体としてアンギオテンシン変換酵素2(ACE2)を用いて細胞内に侵入することがいくつかの研究で報告されている(3,29-31).
ACE2は主にフェレットの気管-気管支粘膜下腺のII型肺細胞および漿液性上皮細胞に発現している(25).
フェレットとネコは,ACE2のSARS-CoV-2スパイク接触領域に2つのアミノ酸差しかない(表S1).したがって,フェレットの下気道におけるSARS-CoV-2の複製を妨げる基礎的なメカニズムについては,未だ検討されていない.
SARS-CoV-2がフェレットの上気道で効率的に複製するという事実は,それらをCOVID-19に対する抗ウイルス薬またはワクチン候補を評価するための候補動物モデルとする.
今回我々が用いたネコは非近交系であり,SARS-CoV-2に感受性を示し,効率よく複製し,ナイーブネコに伝播した.
武漢のネコはSARS-CoV-2に対して血清陽性であることが報告されている(32).
ネコにおけるSARS-CoV-2のサーベイランスは,ヒトにおけるCOVID-19の排除の補助として考慮すべきである.
**********************
いかがでしたか?
動物園のトラのSARS-CoV-2感染もニュースになってましたね!
ネコ科ってことでよいのでしょうか???
以上 (^_^ゞ


コメント