ウイルスのトロピズム
www.ncbi.nlm.nih.gov/pmc/articles/PMC3411105/
ウイルスの最も重要で傑出した特徴の1つは、細胞および宿主指向性です(Levine and Enquist,2007)。たとえばネコに感染するコロナウイルスはヒトには感染しません。この「ウイルスが宿主を選り好みする」性質はウイルスのトロピズムViral Tropismと呼ばれています。寄生体として、ウイルスは生存のために標的細胞に存在する多くの因子と折り合いをつける必要があります。細胞との適切な相互作用がない場合、ウイルスは全く複製しません。したがって、ウイルス親和性は、細胞への侵入から始まり、細胞からの子孫産生で終わる各複製ステップで決定できます。ウイルスのトロピズムには2つの主要なタイプがあります。つまり、受容体依存性と非依存性性です。ウイルス複製の制限は、細胞表面(受容体依存性ウイルス侵入段階)および/または細胞内(受容体非依存性の侵入後複製段階)で発生します。
受容体依存性ウイルストロピズム(宿主プロテアーゼ依存性ウイルストロピズム)
ウイルスは、受容体のある細胞に感染し、受容体の無い細胞には感染できません。それがネコのコロナウイルスがヒトに感染できない原因です。
受容体におけるトロピズムを規定するのが、宿主のプロテアーゼとウイルス膜融合タンパクとの相互関係で明らかになっていて、宿主プロテアーゼ依存性ウイルストロピズムと呼ばれています。
ウイルスのエンベロープタンパクはプロテアーゼで特定の部分が切断されて形を変容させることで細胞膜との融合が可能となります。
マスキング
1.培養細胞であるL細胞に一度感染したセンダイウイルスSeV(L-Sev)は、卵で継代したSeVと異なり、溶血能力やL細胞に対する感染性が消失するという現象があり、これを宿主細胞によるウイルスの生物活性のマスキングとよびます。
2.マスキングはトリプシン(タンパク分解酵素)で処理するとウイルスの活性は復活します。
3.マスキングにより細胞へのウイルスの侵入が阻害されている。
4.トリプシンによりSeVのエンベロープ糖タンパクが開裂することで活性化されることがマスキングの本体。
ということがわかっています。
ウイルスの病原性とプロテアーゼ
ウイルスには弱毒株、強毒株がありますが、何がそれを規定するのでしょうか?
これも、ウイルスの膜融合タンパクのプロテアーゼによる開裂性と高い相関性があります。
弱毒株の場合にはトリプシンが必要で、トリプシンが存在しないと培養細胞への感染能を欠いた非活性型粒子しか産生しませんが、強毒株では培養細胞での増殖(F
タンパクの開裂活性化)にトリプシンは不要で、常に活性型の粒子が産生されます。
さらに、強毒株弱毒株の臓器指向性を解析してみると、強毒株が全身臓器で増殖するに対して、弱毒株は特定の臓器でしか増殖しないことがわかっています。
COVID-19における重症度とウイルス量の関係についてはこちらをご覧ください。
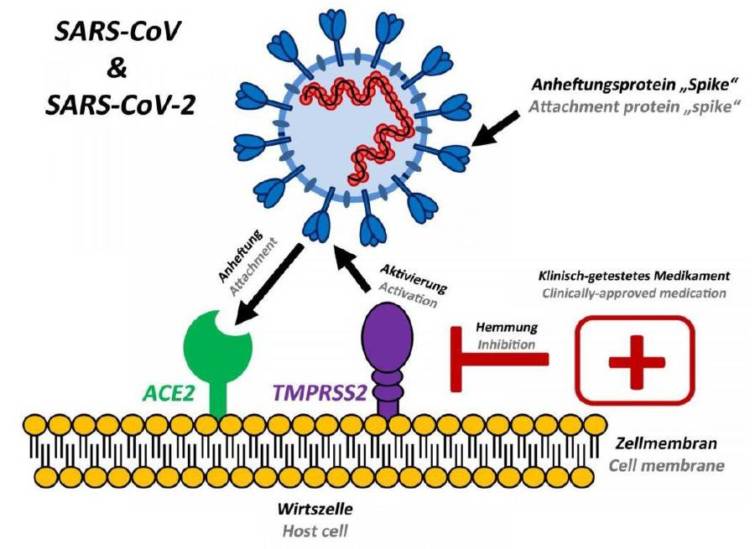
TMPRSS2
前立腺や気道上皮に発現しているTMPRSS2(II 型膜貫通型セリンプロテアーゼの一種)がA型インフルエンザウイルスIAV を開裂活性化することが2004年に報告されました。
TMPRSS2は不活性型前駆体として発現し、自己開裂することによって活性型となります。すなわち、自分自身を酵素活性の基質として切断する、つまり自身の内部に自己開裂配列を持ちます。これがTMPRSS2 のP3-P1ではQSR配列、類似酵素のHATではEQRとなります。
TMPRSS2 のQSR 配列は多くの呼吸器ウイルスの膜融合タンパクの開裂部に保存されている(生物種を超えて同じ配列があることを保存されているといいます)ことが明らかになりました。
TMPRSS2はA型インフルエンザウイルス、ヒトパラインフルエンザウイルス1~4型、コロナウイルスなど様々なヒトの呼吸器に感染するウイルスを開裂活性化することが確認されています。
コロナウイルスの場合
TMPRSS2 による開裂活性化は、重篤な新興呼吸器感染SARS-cov-1やMERS-CoV、そして一般的な風邪の原因となる229E-、OC43-、HKU1-CoVにおいても観察されることが明らかにされてきました。CoV開裂活性化の機構は、他のウイルスと異なっています。
他のウイルスでは、ウイルス膜融合タンパク(S タンパク)の合成や輸送、ウイルスの粒子形成過程においてTMPRSS2 が利用されるのですが、CoVno場合は受容体に結合した後、細胞へ侵入しようとする過程でTMPRSS2によるSタンパクの開裂活性化のみが行われるようです。CoV は、エンドゾーム内のカテプシンを使った開裂活性化経路でも細胞へ侵入できますが、TMPRSS2経路が優先的に使用されることが229E-、OC43- HKU1-CoVにおける研究で示されています。
SARS-cov-2のスパイクの構造
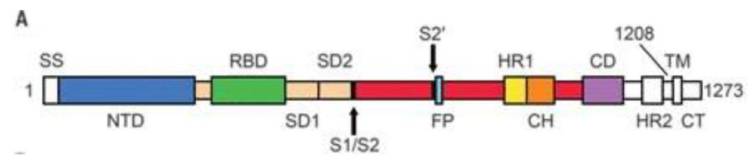
SARS-cov-2のスパイクは3本のSタンパクからなる三量体で、そのモノマーの模式図になります。
左端がN末、右のC末はウイルスエンベロープに陥入しています。
感染細胞内でSタンパクが合成されてウイルス粒子に装着される過程で細胞内のプロテアーゼによりS1とS2に開裂しています。
レセプターであるACE2に結合したSタンパクは、すでにS1/S2の部分で開裂している状態で、S2’にアクセスしやすくなっていて、TMPRSS2(Trans-Membrane Proteine Serine Protease 2)の作用でS2’が切断され、S2のN末にFusion Proteinが露出して膜融合能を獲得します。
SARS-cov-2とSARS-cov-1、MERS-CoVの違い
スパイクの開裂状況
SARS-cov-1ではスパイクは開裂していないが、SARS-cov-2とMERS-CoVでは開裂している
☞開裂していると酸に弱い構造となるため、SARS-cov-2は呼吸器を中心として感染しているのは胃酸にたえられないからではないか?
これは、開裂部位cleavable siteが細胞内のプロテアーゼの基質となりやすいかどうかで決まり、SARS-cov-2とMERS-CoVはその開裂部位にアルギニン酸、リジンというプロテアーゼの基質となる塩基性アミノ酸が連続して存在します。このため、この二つのウイルスは合成された段階でS1/S2が開裂していて、塩基性アミノ酸が露出しているために胃酸に弱く、消化器症状を起こしにくいのではないかと推測されます。COVID-19で下痢症状のある症例が報告されていますが、胃酸の分泌状況がどうだったのか?制酸剤を飲んでいなかったかとか気になります。また、SARS-cov-2では消化管からの検体でRT-PCR陽性でも感染性があることがほとんど証明されない理由も酸に弱いためと考えるとつじつまが合います。
これに対してSARS-cov-1ではS1/S2の開裂が起こっておらず閉じているため、胃酸には耐えられ、このため激しい下痢を伴う症例が報告されているのではないかと考えられます。
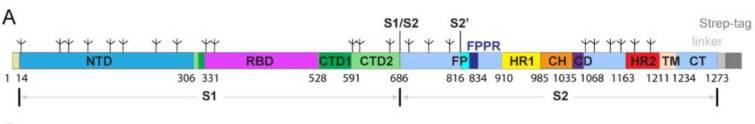
NTD, N-terminal domain; RBD, receptor-binding domain; CTD1, C-terminal domain 1; CTD2, C-terminal domain 2; S1/S2, S1/S2 cleavage site; S2’, S2’ cleavage site; FP, fusion peptide; FFPR, fusion peptide proximal region; HR1, heptad repeat 1; CH, central helix region; CD, connector domain; HR2, heptad repeat 2; TM, transmembrane anchor; CT, cytoplasmic tail; and tree-like symbols for glycans.A strep-tag was fused to the C-terminus of S protein by a flexible linker. https://www.biorxiv.org/content/10.1101/2020.05.16.099317v1.full
☞何のためにもともとS1/S2がSARS-cov-2とMERS-CoVで開裂しているのか?
どのみち、受容体であるACE2に結合すると、細胞表面のTMPRSS2により開裂するため、必要なのかと言われると疑問な過程。
しかし、開裂しているため、少ない密度のACE2を発現する細胞でACE2に効率よく結合できるのではと考えると、ACE-2は肺胞や細気管支の細胞で多く発現されているので、SARS-cov-1はこれらに感染可能である一方ACE2の少ない上気道細胞に感染できないが、SARS-cov-2はACE-2発現の少ない上気道細胞に感染可能であることの説明がつきますね。
いかがでしたか?
こちらをひろみチャンネルで本日撮影に使ったら、スタッフから、「毒性との関係を教えてほしい」という質問をいただきました。
誠実をモットーとしているため、わかる範囲で、必死に書きました!
こうして質問されるたびに、いろんなものを調べまくりお勉強してきたことで、今の私があります。
皆さん、鍛えていただきまして有難うございます!
お医者さんとはこうしてお勉強アルのみで大変ですが、わたしは誇りにおもって頑張ってます (^_^ゞ




コメント