COVID-19の薬理学的治療の総説がJAMA(Journal of Journal of American Medical Association)に掲載されました
jamanetwork.com/journals/jama/fullarticle/2764727
こちらの論文からご紹介したいと思います.
JAMAは2017年のインパクトファクター47.7.堂々の医学系第3位というとんでもない優れた雑誌です.
ちなみに
1位 NEJM (New England Journal of Medicine) ニューイングランドジャーナルオブメディシン IF=79.258
2位 THE LANCET (ランセット) IF=53.254
3位 JAMA (The Journal of the American Medical Association;米国医師会雑誌) IF=47.7
となっています.
リファレンスの番号はつけておきますので,元論文で見てください.
重要性
新型重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス病2019(COVID-19)のパンデミックは,予防・治療に有効な薬剤を同定する前例のないことが課題となっている.SARS-CoV-2に急速に感染した多数の人々によって得られた科学的発見と臨床データの急速なデータペースを考えると,臨床医はこの感染に対する効果的な医学的治療に関する正確なエビデンスを必要としている.
観察
現在のところ,このウイルスに対する有効性が証明された治療法は存在しない.SARS-CoV-2ウイルス学に関する知識が急速に拡大していることから,薬物標的となる可能性がかなり高い.最も有望な治療法はレムデシビルである.レムデシビルはSARS-CoV-2に対して強力なin vitro活性を有するが,米国食品医薬品局の承認を受けておらず,現在進行中のランダム化試験で試験中である.オセルタミビル(商品名タミフル)は有効性が示されておらず,コルチコステロイドは現在のところ推奨されていない.現在の臨床エビデンスでは,COVID-19患者におけるアンジオテンシン変換酵素阻害薬またはアンジオテンシン受容体拮抗薬の中止は支持されていない. →高血圧の患者さんたち,勝手に薬をやめないでください.(仲田)
結論と関連性
COVID-19のパンデミックは1918年のパンデミック・インフルエンザ発生以来,世界最大の公衆衛生危機となっている.COVID-19の潜在的な治療法を検討するために開始された臨床試験のスピードと件数は,パンデミックの途中でも質の高いエビデンスを生み出す必要性と能力の両方を強調している.現在まで有効性が示されている治療法はない.
序文
重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)に起因する新型コロナウイルス病(COVID-19)の世界的大流行は,2019年12月に中国・武漢で始まり世界的に広がっている.1 2020年4月5日現在,200カ国以上で120万人以上が報告され,69,000人が死亡している.この新型Betacoronavirusは,重症急性呼吸器症候群コロナウイルス(SARS-CoV)および中東呼吸器症候群コロナウイルス(MERS-CoV)と類似しているというその遺伝的近接性に基づき,未知の中間哺乳類宿主を介してヒトへ広がったコウモリ由来コロナウイルスに由来する可能性が高い.1 SARS-CoV-2のウイルスゲノムの迅速な配列決定は,診断検査,疫学的追跡,および予防・治療戦略の開発を可能にした.
現在のところ,COVID-19が疑われる患者または確認された患者のいずれかの潜在的な治療法によって転帰が改善するというランダム化臨床試験(RCT)のエビデンスはない.予防的治療を支持する臨床試験データはない.現在,300を超える実薬臨床試験が進行中である.この記述的レビューは,COVID-19の主要な提案された治療,目的を変更した治療または実験的治療に関する現在のエビデンスを要約し,この新規流行性コロナウイルスに関する現在の臨床経験および治療ガイダンスの要約を提供する.
方法
PubMedを用いて文献レビューを行い,2020年3月25日までに発表された関連する英語論文を同定した.検索用語はコロナウイルス,重症急性呼吸器症候群コロナウイルス2, 2019-nCoV, SARS-CoV-2, SARS-CoV, MERS-CoV, COVID-19と治療および薬理を併用した.検索の結果,総論文数は1315件であった.RCTがないため,著者らは症例報告,ケースシリーズ,レビュー論文も含めた.著者らは,別々にタイトルと抄録をレビューに含めた.引用文献のレビューから追加の関連論文を同定した.ClinicalTrials.gov上の疾患検索用語コロナウイルス感染および中国臨床試験登録における新規コロナウイルス肺炎の検討の指標を用いて,積極的な臨床試験を同定した.2
SARS-CoV-2:ウイルス学と薬剤標的
一本鎖RNAエンベロープウイルスであるSARS-CoV-2は,アンジオテンシン変換酵素2(ACE2)受容体に結合するウイルス構造スパイク(S)タンパクを介して細胞を標的とする.レセプターが結合すると,ウイルス粒子は宿主細胞のレセプターとエンドソームを使って細胞内に侵入する.宿主の2型膜貫通セリンプロテアーゼであるTMPRSS2は,Sタンパクを介した細胞侵入を促進する.3いったん細胞内に入ると,レプリカーゼ-転写酵素複合体をコードするウイルスポリタンパクが合成される.ウイルスはRNA依存性RNAポリメラーゼを介してRNAを合成する.構造タンパクが合成され,ウイルス粒子の集合と放出が完了する.4-6これらのウイルスライフサイクルステップは,薬物療法の潜在的な標的となる(図).
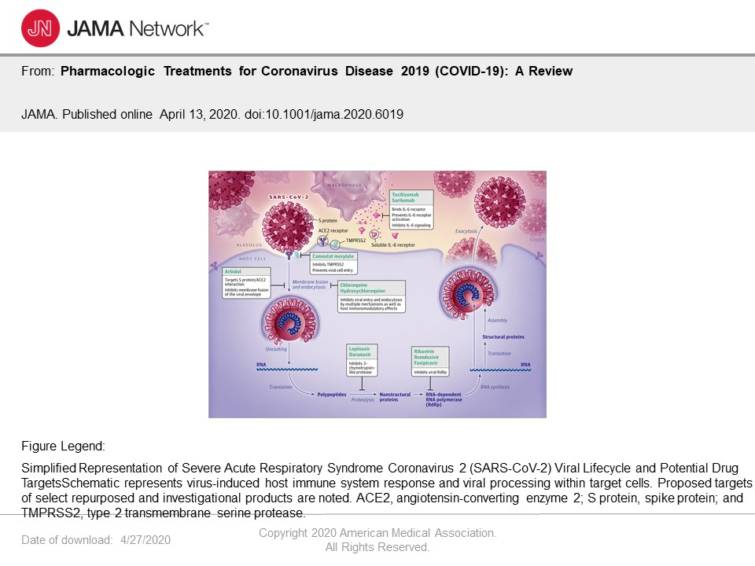
有望な薬物標的には,他の新規コロナウイルス(nCoV)と相同性を共有する非構造タンパク(例,3-キモトリプシン様プロテアーゼ,パパイン様プロテアーゼ,RNA依存性RNAポリメラーゼ)がある.その他の薬物標的には,ウイルスの侵入および免疫調節経路がある.7,8
表1は,COVID-19に対して提案されている選択された治療または補助療法の作用機序および主要な薬理学的パラメータをまとめたものである.
進行中の臨床試験
ClinicalTrials.gov上の検索用語COVID OR coronavirus OR SARS-COV-2には351件の実薬試験があり,2020年4月2日時点でCOVID-19に特異的な291件の試験があった.これら291件の試験のうち,約109件の試験(未募集,募集中,募集終了)には,成人患者を対象としたCOVID-19の治療のための薬物療法が含まれていた.この109件の試験のうち,82件は介入研究であり,29件のプラセボ対照試験がある.検討の記述によれば,11のフェーズ4,36のフェーズ3,36のフェーズ2,および4のフェーズ1の試験がある.22件の試験は,フェーズ別に分類されていないか,該当しない試験であった.
※フェーズ1では薬物動態と毒性をみます
フェーズ2では安全性および有効性・用法・用量をみます
フェーズ3では有効性を検証します
フェーズ4は市販後の調査をさします
主な医薬品
以前にSARSおよびMERSの治療に使用された薬剤は,COVID-19の治療の潜在的候補である.SARSおよびMERSのアウトブレイク中には,SARS-CoVおよびMERS-CoVに対して明らかなin vitro活性を有する様々な薬物が使用されたが,有効性は一貫していなかった.SARSおよびMERS治療研究のメタアナリシスでは,特定のレジメンの明らかな有益性は認められなかった.37,38 以下では,COVID-19の最も有望な再利用薬のいくつかについて,in vitro活性および公表された臨床経験をレビューする.
クロロキンとヒドロキシクロロキン
クロロキンおよびヒドロキシクロロキンは,マラリアの予防および治療,ならびに全身性エリテマトーデス(SLE)および関節リウマチ(RA)を含む慢性炎症性疾患の治療に長年の歴史がある.7 クロロキンおよびヒドロキシクロロキンは,宿主受容体のグリコシル化,タンパク分解プロセシング,およびエンドソームの酸性化を阻害することにより,細胞へのウイルス侵入を遮断するようである.また,これらの薬剤は,宿主細胞におけるサイトカイン産生の減弱とオートファジーおよびリソソーム活性の阻害を介した免疫調節作用を有する.9,10 クロロキンはin vitroでSARS-CoV-2を阻害し,低マイクロモル範囲で半最大有効濃度(EC50)を示す.ヒドロキシクロロキンはin vitroでの活性を有し,24時間の成長後にクロロキンと比較してSARS-CoV-2に対するEC50は低い(ヒドロキシクロロキン: EC50 = 6.14μMおよびクロロキン: EC50 = 23.90μM).15
SARSまたはMERSのクロロキン/ヒドロキシクロロキン治療の有効性に関する質の高いエビデンスは存在しない.中国から報告されたニュースブリーフィングでは,一連の100例を超えるCOVID-19症例の治療にクロロキンが使用され,X線所見の改善,ウイルスクリアランスの増強,および疾患進行の抑制が得られたことが報告されている.39 しかしながら,ピアレビューのための臨床試験デザインおよびアウトカムデータはまだ提示されておらず,また発表されておらず,これらの主張の検証が妨げられている.36人の患者(ヒドロキシクロロキン群20人および対照群16人)を対象とした最近の非盲検非ランダム化フランス試験では,ヒドロキシクロロキン200mgを8時間毎に経口投与することにより,標準的な支持療法を受けている対照患者と比較してウイルス学的クリアランスが改善したことが報告された.鼻咽頭スワブで測定した6日目のウイルス学的クリアランスは,ヒドロキシクロロキン群および対照群でそれぞれ70%(14/20)対12.5%(2/16)であった(P = .001).著者らはまた,ヒドロキシクロロキンにアジスロマイシンを追加した6例では,ヒドロキシクロロキン単独療法(8/14例,57%)と比較してウイルスクリアランスが数値的に優れていた(6/6例,100%)ことを報告した.16
これらの有望な結果にもかかわらず,この研究にはいくつかの大きな限界があった:
少数の症例数(介入群ではわずか20例,ヒドロキシクロロキンとアジスロマイシンの投与を受けたのはわずか6例);
重大な疾患または薬剤の不耐性に起因する治療の早期中止による解析からヒドロキシクロロキン群の6例を除外した;
ヒドロキシクロロキン単独療法群と併用療法群との間の様々なベースラインウイルス量;
および報告された臨床的または安全性のアウトカムはなかった.
併用療法による相加的な心毒性の懸念と相まって,これらの限界は,追加研究なしではこのレジメンの採用を支持しない.中国の患者30人を対象とした別のプロスペクティブ研究では,ヒドロキシクロロキン400mg,1日1回,5日間+標準治療(支持療法,インターフェロン,および他の抗ウイルス薬)または標準治療単独に患者を1:1の方法でランダム化したが,ウイルス学的転帰に差は認められなかった.7日目のウイルス学的クリアランスは同程度であり,ヒドロキシクロロキン+標準治療群および標準治療群でそれぞれ86.7%対93.3%のクリアランスが認められた(P >.05)17. (仲田:Pが0.05未満 ならば有意差ありということです.)
現在,COVID-19治療における役割を検討しているクロロキンとヒドロキシクロロキンの両方のRCTがいくつかある.
医療従事者におけるクロロキン予防(NCT04303507)および高リスク曝露後の曝露後予防のためのヒドロキシクロロキン(NCT04308668)の研究が計画または登録されている.40
COVID-19を治療するためのクロロキンの投与は,500mgを1日1回または2回経口投与することから構成されている.11,12
しかし,クロロキンの安全性と有効性を保証するための至適用量に関するデータは不足している.SLEに対するヒドロキシクロロキンの推奨用量は,一般に1日400mg経口投与である.18 しかしながら,生理学に基づく薬物動態モデリング研究では,COVID-19治療におけるヒドロキシクロロキンの至適用法は,負荷用量400mgを1日2回,1日間投与した後,200mgを1日2回投与することであると推奨されている.15対照的に,ホウィップル病に対する安全性および臨床経験に基づいて,600mg/日の総投与量については別の推奨がなされている11.COVID-19の至適用量を明らかにするためには,さらなる研究が必要である.
クロロキンおよびヒドロキシクロロキンは,SLEおよびマラリアの患者における広範な経験によって実証されているように,比較的忍容性が良好である.しかしながら,両剤とも,QTc延長,低血糖,精神神経系への影響,網膜症など,まれで重篤な有害作用(10%未満)を引き起こす可能性がある.41,42 特に重症患者およびアジスロマイシンやフルオロキノロン系薬剤などのQT間隔延長薬を併用している患者では,不整脈の可能性があるため,これらの薬剤の開始前および開始後にQTc延長を評価するためのベースライン心電図検査が望ましい.13 COVID-19で提案されている用量および期間でのクロロキンの妊娠におけるクロロキンおよびヒドロキシクロロキンの使用は,一般に安全であると考えられているが,重大な有害作用は報告されていない.13,18 妊娠中にクロロキンまたはヒドロキシクロロキンを投与された患者588例を含む12件の研究のレビューでは,明らかな乳児の眼毒性は認められなかった.43
ロピナビル/リトナビルとその他の抗レトロウイルス薬
HIV治療のための米国食品医薬品局(FDA)承認経口配合剤であるロピナビル/リトナビルは,3‐キモトリプシン様プロテアーゼの阻害を介して他の新規コロナウイルスに対するin vitro活性を実証した.21,22 ロピナビル/リトナビルについて発表されたSARS-CoV-2のin vitroデータは存在しない44 SARSおよびMERSの治療のためのロピナビル/リトナビルの系統的レビューでは,入手可能な研究は限られており,これらのほとんどがSARSで検討していた.SARSにおける臨床研究は,死亡率と挿管率の低下と関連していたが,それらの後ろ向きという観察的性質で決定的な結論は得られない.ロピナビル/リトナビルによる治療開始の遅延は臨床転帰に影響を及ぼさなかったことから,ウイルス複製の初期ピーク期(初期7~10日)の投与タイミングは重要であると思われる.45,46
COVID-19の治療に対するロピナビル/リトナビルの初期の報告はほとんどが症例報告であり,小規模なレトロスペクティブ非ランダム化コホート研究であるため,ロピナビル/リトナビルの直接的な治療効果を確認することは困難である.45,46 さらに最近,Caoら23はCOVID-19の患者199例を対象に,ロピナビル/リトナビルと標準治療の有効性を比較した非盲検RCTの結果を報告した.重要なことは,症状発現から無作為化までの期間の中央値は13日(四分位点間距離[IQR],11~16)であり,群間差は認められなかったことである.7 カテゴリーの順序尺度または退院時における2ポイントの改善によって定義された臨床的改善までの時間の主要アウトカムは,両群で同様であった(16日[IQR,13~17]対16日[IQR,15~17];ハザード比[HR],1.31[95% CI,0.95~1.85]; P = .09).さらに,ウイルスクリアランスまたは28日死亡率に有意差は認められなかった(19.2%対25.0%;絶対差,-5.8%[95% CI,-17.3%~5.7%]).治療開始の遅れは,COVID-19の治療に対するロピナビル/リトナビルの無効性を部分的に説明する可能性があるが,サブグループ解析では,12日以内に治療を受けた患者の方が臨床的改善までの期間が短いことは認められなかった(HR,1.25[95% CI,0.77-2.05]).23ロピナビル/リトナビルに関する追加のRCTが進行中であるが,今回のデータはCOVID-19治療におけるロピナビル/リトナビルの役割は限られていることを示唆している.
COVID-19治療のために最も一般的に使用され,研究されているロピナビル/リトナビル投与レジメンは,400mg/100mgを1日2回,最長14日間である.12,23 重大な薬物間相互作用及び潜在的な副作用(表1に要約)を考慮すると,本剤を使用する場合には,併用薬の慎重な検討及びモニタリングが必要である.ロピナビル/リトナビルの有害作用には,悪心および下痢(最大28%)などの消化器症状および肝毒性(2%~10%)がある.24 COVID-19の患者では,患者の約20%~30%がトランスアミナーゼ値が上昇しており,最近のRCTではロピナビル/リトナビル患者の約50%が有害作用を経験し,患者の14%が消化管の有害作用により治療を中止したことが示されたため,これらの有害作用は併用療法またはウイルス感染によって悪化する可能性がある.23 薬剤性肝障害は,COVID-19に起因する肝障害を悪化させる可能性があるため,特に懸念される.重要なことに,いくつかのCOVID-19試験ではアラニントランスアミナーゼ上昇が除外基準となっており,ロピナビル/リトナビル誘発性肝毒性が患者のこれらの他の薬剤へのアクセス能力を制限しうることを意味している.40
プロテアーゼ阻害剤およびインテグラーゼ鎖転移阻害剤を含む他の抗レトロウイルス剤は,SARS-CoV-2活性を有すると酵素活性スクリーニングによって同定された.44in vitro細胞モデルでは,SARS-CoV-2に対するダルナビルの活性が実証された.これらの薬剤を用いたCOVID-19のヒト臨床データはないが,中国でダルナビル/コビシスタットのRCTが進行中である.40
リバビリン
グアニンアナログ(仲田:アナログは偽物という意味です)であるリバビリンは,ウイルスのRNA依存性RNAポリメラーゼを阻害する.他のnCoVに対する活性から,COVID-19治療の候補となる.しかしながら,SARS-CoVに対するin vitro活性は限られており,ウイルス複製を阻害するために高濃度を必要とし,高用量(例,8時間毎に1.2gから2.4gを経口投与)および併用療法が必要となった.患者は以前の試験で静脈内投与または経腸投与のいずれかを受けた.37nCoV治療のための吸入リバビリンについての証拠は存在せず,RSウイルスを用いたデータは,吸入投与が経腸投与または静脈内投与を上回る利益を提供しないことを示唆している.48
SARS治療のためのリバビリンの臨床経験を系統的にレビューしたところ,レビューした30件の研究のうち26件で決定的な結果が得られず,4件の研究で血液毒性および肝毒性を含む有害作用による可能性が実証された.37MERSの治療において,リバビリンは,一般にインターフェロンと併用して,臨床転帰またはウイルスクリアランスに対して識別可能な効果を示さなかった.38,49SARS-CoV-2に対するリバビリンの臨床データが不足していることは,その治療的役割を他のnCoVデータから外挿しなければならないことを意味する.
リバビリンは重度の用量依存的な血液毒性を引き起こす.SARS試験で使用された高用量は60%以上の患者で溶血性貧血をもたらした.37最大規模のMERS観察試験でも同様の安全性の懸念がみられ,約40%の患者が輸血を必要とするリバビリン+インターフェロンを服用していた.49SARSに対してリバビリンを服用した患者の75%がトランスアミナーゼ上昇を経験した.37 リバビリンは催奇形物質としても知られており,妊娠中は禁忌である.50
他のnCoVに対するリバビリンの決定的でない有効性データおよびその実質的な毒性は,COVID-19の治療に対する価値が限られていることを示唆している.併用療法を実施すれば,臨床効果が得られる可能性が最も高い.
その他の抗ウイルス薬
インフルエンザの治療に承認されたノイラミニダーゼ阻害剤であるオセルタミビル(商品名:タミフル)は,SARS-CoV-2に対するin vitro活性は立証されていない.中国におけるCOVID-19のアウトブレイクは,最初はインフルエンザシーズンのピーク時に発生したため,COVID-19.51の原因としてSARS-CoV-2が発見されるまで経験的オセルタミビル療法を受けた患者の割合が非常に高かった.現在の臨床試験のいくつかには,比較群にオセルタミビルが含まれているが,提案されている治療介入としては含まれていない.40この薬剤は,インフルエンザが除外された後のCOVID-19の管理には役割を果たしていない.
ウミフェノビル(アルビドールとしても知られる)は,Sタンパク/ACE2相互作用を標的とし,ウイルスエンベロープの膜融合を阻害する独特の作用機序を有する,より有望な再目的抗ウイルス薬である.27この薬剤は現在,インフルエンザの治療および予防のためにロシアおよび中国で承認されており,SARSに対する活性を示唆するin vitroデータに基づいてCOVID-19の治療に対する関心が高まっている28.現在,インフルエンザに対して8時間ごとに200mgを経口投与する用量がCOVID-19の治療薬として研究されている(NCT04260594).COVID-19に対するウミフェノビルの臨床経験は,中国では限られていることが記載されている.COVID-19の患者67人を対象とした非ランダム化研究では,ウミフェノビルによる治療期間中央値9日間は,薬剤を投与されなかった患者と比較して死亡率が低く(0%[0/36]対16%[5/31]),退院率が高いことが示された.29 この観察データはCOVID-19に対するウミフェノビルの有効性を確立することはできないが,中国で進行中のRCTはこの薬剤をさらに評価している.
その他の薬剤
インターフェロン-αおよび-βはnCoVについて研究されており,インターフェロン-βはMERSに対して活性を示している37,38 公表されている研究のほとんどが,リバビリンおよび/またはロピナビル/リトナビルと併用した治療の結果を報告している.他の薬剤と同様に,治療が遅れると,これらの薬剤の有効性が制限される可能性がある.相反するin vitroおよび動物データと臨床試験がないことを考慮すると,SARS-CoV-2を治療するためのインターフェロンの使用は現時点では推奨できない.52現在の中国のガイドラインでは,併用療法の代替薬としてインターフェロンが挙げられている.12伝統的に非感染性の適応症に使用される幾つかの他の免疫調節剤は,in vitro活性を実証するか,またはSARS-CoV-2を阻害するとされるメカニズムを有し,これにはバリシチニブ,イマチニブ,ダサチニブ,およびシクロスポリンが含まれるが,これらに限定されない.53-57しかしながら,COVID-19の使用を推奨する動物またはヒトのデータは存在せず,既に他の適応症で服用している患者に保護効果をもたらすかどうかは依然として確認されていない.
ニタゾキサニドは伝統的に駆虫薬であり,広範な抗ウイルス活性を有し,比較的良好な安全性プロファイルを有する.ニタゾキサニドは,MERSおよびSARS-CoV-2.58,59に対するin vitro抗ウイルス活性を示しており,さらなるエビデンスが得られるまで,ニタゾキサニドの抗ウイルス活性,免疫調節作用,および安全性プロファイルは,SARS-CoV-2に対する治療の選択肢として,さらに試験を進める必要がある.
膵炎治療のために日本で承認された薬剤であるメシル酸カモスタットは,宿主セリンプロテアーゼ,TMPRSS2.3の阻害を介してin vitroでnCoV細胞侵入を防止する.この新規メカニズムは,将来の研究のための追加的な薬剤標的を提供する.
SARS-CoV-2は,宿主細胞への侵入にACE2受容体を用いる.3 この発見は,ACE阻害薬および/またはアンジオテンシン受容体遮断薬がCOVID-19を潜在的に治療するか,または逆に疾患を悪化させるかについての議論を刺激した.60 これらの薬物はACE2受容体をアップレギュレート(仲田:受容体阻害薬を投与すると,受容体自体が増えることをいいます)し,理論的にはウイルス侵入が増強されると転帰が悪化する可能性がある.対照的に,アンジオテンシン受容体遮断薬は,理論的にはACE2受容体の遮断を介して臨床的利益をもたらす可能性がある.COVID-19を有する患者において,これらの薬剤が有害または保護作用を有するかどうかを判定するための相反するin vitro(仲田:試験管内)データが存在する.さらなる研究が行われるまでは,臨床学会および診療ガイドラインでは,これらの薬剤のうち1剤をすでに服用している患者に対して治療の継続が推奨されている.61,62
治験薬の選定審査
レムデシビル
正式にはGS-5734として知られているレムデシビルは,活性型C-アデノシンヌクレオシド三リン酸アナログへの代謝を受ける一リン酸プロドラッグである.この薬剤は,コロナウイルス科やフラビウイルス科などのRNAウイルスに対して活性を有する抗ウイルス薬のスクリーニング過程の中で発見された.本剤の研究開発は,EC50が低く,エボラウイルスに対する宿主ポリメラーゼ選択性が高いことから,エボラウイルスアウトブレイクの高さの間,有望であることを示した.30 現在,レムデシビルは,EC50およびEC90値がそれぞれ0.77μMおよび1.76μMのSARS‐CoV‐2を含むいくつかのnCoVに対して,その広域スペクトル,強力なin vitro活性のため,COVID‐19の有望な潜在的治療法である.31,58 MERS-CoVによるマウス肺感染モデルにおいて,レムデシビルは,対照薬よりも肺出血を予防し,ウイルス肺力価を低下させた.32
レムデシビルの安全性および薬物動態は,単回および反復投与の第1相臨床試験で評価した.633mgから225mgの間の静脈内注入は,肝臓または腎臓毒性の証拠なしに良好な忍容性を示した.レムデシビルはこの用量範囲内で直線的な薬物動態を示し,細胞内半減期は35時間を超えた.反復投与後,可逆的なアスパラギン酸アミノトランスフェラーゼおよびアラニントランスアミナーゼの上昇が生じた.現在検討中の用量は,200mgの負荷用量を単回投与した後,100mgを1日1回点滴静注するものである.現時点では肝・腎機能による容量調整は推奨されないが,推算糸球体濾過量が30mL/min未満の患者では開始は推奨されない.
レムデシビルの最初の臨床使用はEbola64の治療のためであった;しかしながら,COVID‐19に対するレムデシビルの使用を記述した成功した症例報告が報告されている.65,66 軽度から中等度または重度のCOVID-19(NCT04292899,NCT04292730,NCT04257656,NCT04252664,NCT04280705)患者を対象に,レムデシビルの安全性および抗ウイルス活性を評価する臨床試験が進行中である.特に重要なのは,米国国立衛生研究所が,支持療法(NCT04280705)と比較したレムデシビルの有効性に光を当てる適応無作為化二重盲検プラセボ対照試験を後援していることである.40 RCTの結果が予想されるため,COVID-19の治療にこの薬剤を含めることを検討してもよい.レムデシビルは現在FDAの承認を受けておらず,特別な使用(18歳未満の小児および妊婦のみ),や臨床試験への登録を介して入手しなければならない.
Favipiravir(アビガン)
ファビピラビルは以前T‐705として知られていたが,プリンヌクレオチドであるファビピラビルリボフラノシル‐5′‐三りん酸のプロドラッグである.活性物質はRNAポリメラーゼを阻害し,ウイルス複製を停止させる.ファビピラビルの前臨床データのほとんどは,インフルエンザおよびエボラ活性に由来するが,本剤は他のRNAウイルスに対しても広範な活性を示した.67 in vitroでは,SARS-CoV-2に対するファビピラビルのEC50はVero E6細胞で61.88μM/Lであった.58
感染症の適応症の種類に基づいて様々な投与レジメンが提案されている.投与量のばらつきは,エボラ出血熱及びSARS-CoV-2.68,69と比較してインフルエンザに対して記載されているファビピラビルのEC50値が低いことに起因する可能性が高いと考えられ,COVID-19.69の治療には,投与範囲のより高い終了時の用量を考慮すべきである.負荷用量(2400mg~3000mgを12時間毎×2回)とその後の維持用量(1200mg~1800mgを12時間毎)が推奨される.半減期は約5時間である.70 高用量レジメンの有害事象プロファイルは限られているものの,この薬剤は軽度の有害作用プロファイルを有し,全般的に忍容性は良好である.44,69,71,72 ファビピラビルは現在,日本ではインフルエンザの治療に使用可能であるが,米国では臨床使用には使用できない.
COVID-19に対するファビピラビルの使用を支持する臨床経験は限られていると報告されている.前向き無作為化多施設試験において,中等度および重度のCOVID-19感染症の治療について,ファビピラビル(n = 120)とアルビドール(n = 120)が比較された.7日目の臨床回復の差は,中等度感染症患者で観察された(ファビピラビル71.4%,アルビドール55.9%,P = .019).重度または重度および中等度(複合)群では有意差は認められなかった.73 これらのデータは,COVID-19の治療に対するファビピラビルの有効性に関するRCTによるさらなる研究を支持するものである.
この提案された薬物のレビューは,必然的に選択的である.American Chemical Societyの部門が実施した最近の包括的レビューでは,2003年以降のヒトコロナウイルスにおける治療薬およびワクチンに関する科学的データが,世界中の公表文献および特許の両方を用いて分析された.74 この解析では,130以上の特許およびヒトコロナウイルスに対する潜在的活性を有する3000以上の潜在的低分子薬物候補が報告された.同じ解析により,治療用抗体,サイトカイン,RNA療法,およびワクチンを含むコロナウイルスに対する活性を有する生物学的製剤の特許500件以上が同定された.SARS-CoV-2-ヒトタンパク-タンパク相互作用マップの別のプレプリント解析により,332の高信頼性タンパク-タンパク相互作用が同定され,既存のFDA承認薬または治験薬のいずれかが標的とする66の候補薬物測定可能なヒトタンパクまたは宿主因子が得られた.75 この大量の潜在的薬剤は,COVID-19に対する有効な治療または予防戦略を見出すために,レースにおいてより多くの候補治療薬をもたらすことが期待される.
補助療法
SARS-CoV-2に対する治療法が証明されていない現在,COVID-19患者に対する治療の基本は,対症的外来管理から完全な集中治療支援まで,依然として支持療法である.しかしながら,特に言及すべき3つの補助療法は,コルチコステロイド,抗サイトカインまたは免疫調節薬,および免疫グロブリン療法である.
コルチコステロイド
コルチコステロイドの使用の理論的根拠は,急性肺損傷および急性呼吸窮迫症候群(ARDS)につながる可能性のある,肺における宿主の炎症反応を減少させることである.しかしながら,この有益性は,ウイルスクリアランスの遅延および二次感染のリスク増加を含む有害作用によって上回る可能性がある.COVID-19におけるコルチコステロイドの直接的なエビデンスは限られているが,他のウイルス性肺炎における転帰のレビューは指導的である.76 SARSおよびMERS患者を対象とした観察研究では,コルチコステロイドと生存率の改善との関連性は報告されなかったが,気道および血液からのウイルスクリアランスの遅延および高血糖,精神病,無血管性壊死などの合併症の高率との関連性が実証された.37,77 加えて,インフルエンザ空気血症患者6548名を対象とした2019年の観察研究の10件のメタアナリシスでは,コルチコステロイドは死亡リスクの増加(リスク比[RR],1.75[95% CI,1.3~2.4]; P < .001)と2倍高い二次性予防リスク(RR,1.98[95% CI,1.0~3.8]; P =0.04.78)に関連していることがわかった.一方,ARDSおよび腐敗性ショックにおけるコルチコステロイドの有効性は,より一般的に論議されたままであるのに対し,Russellら76は,コルチコステロイドから利益を得る可能性が最も高いものは,ウィルシャル伝播ではなく菌性のものであると主張した.中国におけるCOVID-19の患者201人を対象とした最近のレトロスペクティブ研究では,ARDSを発症した患者について,メチルプレドニゾロンによる治療は死亡リスクの低下と関連していた(ステロイドで23/50[46%]対非発症で21/34[62%]; HR,0.38[95% CI,0.20-0.72]).47 しかし,著者らは,この観察研究では,ステロイド投与の有無によるバイアスと交絡の残存が存在する可能性があると指摘した.したがって,コルチコステロイドの潜在的な有害性および有益性が証明されていないことから,慢性閉塞性肺疾患増悪または難治性ショックなどの説得力のある適応症が併存しない限り,RCT以外のCOVID-19患者におけるルーチンの使用には注意を払う必要がある.
抗サイトカイン薬または免疫調節薬
主要な炎症性サイトカインまたは先天性免疫応答の他の側面に対するモノクローナル抗体は,COVID-19に対する別の潜在的なクラスの補助療法である.その用途の理論的根拠は,肺および他の臓器における重大な臓器障害の根底にある病態生理が,増幅された免疫応答およびサイトカイン放出,すなわち「サイトカインストーム」によって引き起こされることである.79 IL-6は,中国からの初期の症例集積に基づくこの調節不全の炎症の鍵となる促進因子であると思われる.80 このように,IL-6に対するモノクローナル抗体は,理論的にはこの過程を抑制し,臨床転帰を改善する可能性がある.モノクローナル抗体IL-6受容体拮抗薬であるトシリズマブは,キメラ抗原受容体T細胞療法後のRAおよびサイトカイン放出症候群の治療薬としてFDAに承認されている.この経験を踏まえて,トシリズマブは重度のCOVID-19症例の小規模シリーズで使用されており,成功が早期に報告されている.COVID-19の患者21例の報告では,呼吸機能の改善,急速な解熱,および退院の成功によって測定したところ,患者の91%でトシリズマブ400mgの投与が臨床的改善と関連しており,ほとんどの患者は1回の投与のみであった.35 対照薬群がないため,薬剤特異的な効果の解釈には限界があり,より厳密なデータが得られるまでは注意が必要である.中国では,重症肺炎を伴うCOVID-19患者を対象としたトシリズマブ単独または併用のいくつかのRCTが進行中であり(NCT04310228,ChiCTR200002976),現在の中国の国家治療ガイドラインに含まれている.12
RAに対して承認された別のIL-6受容体拮抗薬であるサリルマブは,重度COVID-19の入院患者を対象とした多施設二重盲検フェーズ2/3試験(NCT04315298)で研究されている.81 中国で臨床試験中または米国で拡大アクセスが可能な他のモノクローナル抗体または免疫調節薬には,ベバシズマブ(抗血管内皮増殖因子薬; NCT04275414),フィンゴリモド(多発性硬化症に対して承認された免疫調節薬; NCT04280588),エクリズマブ(末端補体を阻害する抗体; NCT04288713)がある.40
免疫グロブリン療法
COVID-19に対する別の潜在的な補助療法は,回復期の血漿または高免疫グロブリンの使用である.82 この治療の理論的根拠は,回収された患者由来の抗体が遊離ウイルスおよび感染細胞の免疫クリアランスの両方に役立つ可能性があることである.SARSおよびMERSにおける救援療法として,回復期血漿の逸話的報告またはプロトコルが報告されている.83,84 H1N1インフルエンザA型の重症患者93例を対象とした2009年の前向き観察研究(うち20例が回復期血漿を投与された)では,回復期血漿の投与と非投与との間に死亡率の低下が認められた(20% vs 54.8%; P = .01)85. 2015年のシステマティック・レビューの一環として,Mair-Jenkinsら86がSARSまたは重症インフルエンザのいずれかの患者714例を含む8件の観察研究の事後メタアナリシスを行った.回復期の血漿および高免疫グロブリンの投与は,死亡率の低下と関連しており(オッズ比,0.25[95% CI,0.14-0.45]; I2=0%),有害性は比較的少なかったが,研究の質は一般的に低く,バイアスのリスクがあった.86理論的には,この治療法の利益は,ウイルス血症がピークに達し,一次免疫応答がまだ起こっていない感染後7~10日以内に主に生じるであろう.現在市販されている免疫グロブリン製剤はSARS-CoV-2に対する防御抗体を欠いている可能性が高いが,COVID-19から回復した患者のプールが世界的に増加しているため,この治療法はさらなる安全性および有効性試験を正当化するものである.実際,中国で回復期血漿で治療されたCOVID-19の重篤患者5例の最初に報告された非対照症例シリーズが最近発表された.87さらに,中国WuhanのCOVID-19患者3例を対象に,免疫グロブリンを0.3~0.5g/kg/日の用量で5日間静脈内投与した症例集積研究が最近発表された.882020年3月24日,FDAは緊急治験薬申請およびCOVID-19回復期血漿のドナースクリーニングの要請に関するガイダンスを発表した.89 また,SARS-COV-2(およびSARS-CoV)感染を阻止するための共通エピトープに対するヒトモノクローナル抗体の前臨床開発について記述した初期のプレプリント報告もある.90
このウイルスの将来の発生を予防するための最も効果的な長期戦略は,防御免疫を提供するワクチンの開発であろう.しかしながら,ワクチンの普及には最低12~18ヵ月が必要であろう.SARS-CoV-2に対するワクチン研究の包括的レビューは,本レビューの範囲を超えている.
最新の臨床治療経験と推奨事項
発表された臨床治療経験は,言及された数少ない臨床試験以外では,大部分が,このパンデミックの初期に影響を受けた中国および他の国からの記述的報告および症例シリーズから構成されている.したがって,症例致死率を含むアウトカムは,交絡および選択バイアスのほか,人口統計学的データ,検査,および治療アプローチのシフトが存在することを考慮すると,慎重に解釈しなければならない.表2は,早期に報告されたCOVID-19症例シリーズから得られた臨床的重症度,合併症,治療,および臨床転帰を要約したものである.
COVID-19患者の臨床ケアのための現行の疾病管理予防センターガイダンス(2020年3月7日現在)では,COVID-19に対する特異的な治療法は存在しないことが強調されており,管理には「推奨される感染予防・制御手段の迅速な実施と合併症の支持的管理」を含めるべきであることを強調している96.疾病管理予防センターのガイダンスでは,特に,他の理由で適応とならない限り,コルチコステロイドは避けるべきであると言及している.治験治療薬,特にレムデシビルは,特別な使用または進行中の臨床試験のいずれかを介して選択肢として挙げられる.
同様に,現行のWHO(World Health Organization)の臨床管理ガイダンス文書(2020年3月13日現在)では,「COVID-19が確認された患者に対して特定の抗COVID-19治療を推奨する現時点でのエビデンスはない.」97 本ガイダンスでは,軽症に対する対症療法からARDSに対するエビデンスに基づく換気管理,重症患者における細菌感染症および敗血症の早期認識と早期治療まで,疾患の重症度に基づく支持療法の役割が強調されている.彼らは「バイラル・コルチコイドの外部臨床試験に対する系統的コルチコステロイドを日常的に支給しない」ことを推奨し,「試験中の抗コビッド-19治療薬は,承認された,無作為化された管理試験でのみ使用すべきである」と述べているが,この点に関し,WHOは最近,地域の医薬品の入手可能性に基づいて,標準治療薬または4つの現役治療アーム(レムデジビル,クロロキンまたはハイドロキシクロロキン,ロピナビル/リトナビル,ロピナビル/リトナビル+インターフェロン-β)のいずれかに確定例をランダム化するようなSOLIDARITYというグローバルなメガトライアルを立ち上げる計画を発表した.98
ボックス1は,特別な集団における薬物間相互作用及びガイダンスのための臨床治療及び他の有用な資源のための主要な米国及び国際ガイダンス文書へのリンクを提供する.ボックス2の回答は,COVID-19患者の臨床管理について臨床医に頻繁に質問された質問である.
ボックス1.
臨床治療ガイダンスおよびその他の有用な情報源
国際的および国または施設の臨床管理ガイダンスの選択
世界保健機関臨床管理ガイダンス(中間ガイダンス,2020年3月13日更新)
米国疾病管理予防センターCOVID-19臨床ケア(中間ガイダンス,2020年3月7日更新)
www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-guidance-management-patients.html
中国国民健康委員会新型コロナウイルス肺炎診断・治療方針(暫定第7版,2020年3月3日更新)
中国原産: www.gov.cn/zhengce/zhengceku/2020-03/04/5486705/files/ae61004f930d47598711a0d4cbf874a9.pdf
英訳: www.chinalawtranslate.com/wp-content/uploads/2020/03/Who-translation.pdf
イタリア感染熱帯病学会 COVID-19患者ケアハンドブック(第2.0版,2020年3月13日更新)
Italian original: www.simit.org/IT/simit/sezioni-regionali.xhtml/sezione/112-lombardia/comunicazioni/1
英訳: drive.google.com/file/d/1eXE6espkYp6_k2XCyTf_6kgT6tFbnQjg/view
ワシントン大学
covid-19.uwmedicine.org/Pages/default.aspx
JAMAネットワークCOVID-19サイト
jamanetwork.com/journals/jama/pages/coronavirus-alert
臨床試験登録/資源
臨床試験(米国)
臨床試験(中国)
www.chictr.org.cn/searchprojen.aspx
米国国立衛生研究所COVID-19ページ
www.nih.gov/health-information/coronavirus
薬物相互作用ウェブサイト
リバプール大学
www.covid19-druginteractions.org/
Micromedex (バージョン2.0)
臨床薬理
事実と比較4.0/Lexicomp
エポクレート
Medscape薬剤参照
特別な集団に対するガイダンス
固形臓器移植
www.myast.org/covid-19-information#
敗血症生存キャンペーン:COVID-19の重症成人の管理に関するガイドライン
jamanetwork.com/journals/jama/fullarticle/2763879
COVID-19パンデミック時のがん患者のケア
jnccn.org/fileasset/jnccn1804-Ueda_20118_preprint.pdf
妊娠
HIV感染者
aidsinfo.nih.gov/guidelines/html/8/covid-19-and-persons-with-hiv中間ガイダンス/0
ボックス2.
COVID-19 臨床管理 : 頻繁に質問される質問
1. COVID-19患者の転帰を改善することが明らかにされている薬物療法はありますか.
現時点では,COVID-19患者の転帰を改善することが確実に示されている薬物療法はない.SARS-CoV-2ウイルスに対するin vitro活性,または観察的または小規模の非無作為化試験で臨床的利益の可能性を実証した薬剤は数多くある.現在,十分な検出力を有するランダム化臨床試験が登録されており,これらの提案された治療法の有効性を確立するために必要である.
2. COVID-19による重度の症状がある患者には,ヒドロキシクロロキンおよび/またはアジスロマイシンを処方すべきか?
COVID-19患者に対するヒドロキシクロロキンとアジスロマイシンの併用の臨床的利益が報告されているのは,媒体報告または少数の参加者(患者数100人未満)を対象とした非ランダム化試験のいずれかによるものである.アジスロマイシンを併用するまたは併用しないヒドロキシクロロキンの有益性が立証されていることは,特に重度の疾患では非常に限られている.これらの薬剤は,単独または併用で有効である可能性があるが,これらの治療を広く採用する前に,ランダム化臨床試験によりこれらの利益を確立する必要がある.
3. 高齢患者およびCOVID-19による重症疾患のリスクが高い患者では,ARB/ACE阻害薬を中止すべきか?
米国疾病管理予防センター,米国心臓協会,米国心不全学会,および米国心臓病学会を含む主要な施設および学会は,すでに別の適応症でこれらの薬剤を処方されているすべての患者に対して,ACE阻害薬またはARB薬の継続を推奨している.現在のところ,これらの薬剤の使用とCOVID-19獲得または疾患の重症度のリスク増大との関連性を立証するヒトでのエビデンスはない.
4. COVID-19患者の管理におけるIL-6受容体拮抗薬またはコルチコステロイドなどの免疫調節薬の役割は何か.
COVID-19の合併症において免疫応答が果たす重要な役割を考えると,積極的な臨床試験ではこの疾患における免疫調節薬(IL-6受容体拮抗薬など)を評価している.炎症マーカーの著明な上昇を特徴とする「サイトカインストーム」の患者では,IL-6受容体拮抗薬の使用を検討することができるが,これらの薬剤は二次感染のリスクを増大させる可能性がある.コルチコステロイドの役割については依然として議論の余地があり,世界保健機関からの現行のガイドラインでは,慢性閉塞性肺疾患増悪または昇圧不応性ショックなど別の併用適応が存在しない限り,その使用を推奨していない.しかしながら,急性呼吸窮迫症候群を有する重症COVID‐19患者におけるそれらの有用性は臨床試験でさらに検討されるべきである.
5. COVID-19の治療に利用される薬剤はなにか.
SARS-CoV-2をはじめとする新規コロナウイルスに対して,多くの薬剤がin vitroで活性を示す.低分子データベーススクリーニングにより,何千もの潜在的な病原体が同定された.このうち,様々な他の病態(例,HIVおよび自己免疫疾患)の治療に使用されるいくつかの再目的薬剤が,COVID-19の治療選択肢として提案されている.ロピナビル/リトナビルおよびクロロキンまたはヒドロキシクロロキンは,COVID-19の治療において,陽性または陰性のいずれかの最も臨床的エビデンスを有する薬剤である.現在までのところ,入手可能な臨床試験では,これらの薬剤のいずれかが明らかに有効であることは実証されていない.
6. COVID-19の治療に使用できる治験薬はあるか?
レムデシビルは,COVID-19感染患者を対象に,臨床試験への登録または緊急アクセスの申請により入手可能である.米国では,疾患の重症度(例,中等度対重度の感染症)および研究デザイン(例,プラセボ対照)によって区別された3件の進行中の臨床試験がある.緊急アクセスは,拡張アクセス・プログラムを通じて利用可能である.臨床試験にアクセスできない施設では,この方法で薬剤を入手できる可能性がある.また,COVID-19が確認され,疾患の重篤な症状が発現した妊婦及び18歳未満の小児に対する個別の思いやりのある使用は,この方法で薬剤を入手する可能性がある.ファビピラビルは現在,米国では入手できない.
7. COVID-19の患者さんが特定の治療を必要とするか,支持療法のみを受けるべきかをどのように判断しますか.
優先順位は,適格であれば臨床試験に患者を登録することであるべきである.これが不可能な場合,外来患者として安定しているか,画像検査で酸素必要量や肺炎のエビデンスがない患者は,一般に支持療法のみで管理できる.低酸素症または肺炎のエビデンスを有する患者,特に65歳以上,心臓または肺の併存疾患,および免疫抑制などの疾患進行のリスク因子を有する患者は,患者とリスクおよびベネフィットについて話し合った上で,地域の病院治療ガイダンスに従って,特異的COVID-19療法を考慮することができる.
8. COVID-19を治療するために薬剤を再利用することの限界について述べよ.
再目的医薬品の使用は,ベネフィット(in vitro/臨床エビデンス)が関連リスク(副作用)を上回るという仮定に依存する.目的を変更した薬剤を使用する際の1つの限界は,これらの薬剤が急性毒性を引き起こす傾向があることである.この急性毒性は,特定の抗ウイルス薬の明らかにされていない有益性を上回る可能性がある.心毒性または肝毒性などの併用療法による毒性の増強は,潜在的な追加リスクを生じさせ,リスク対ベネフィット分析を綿密に行う必要がある.全体として,明らかな利益を実証するエビデンスが不足していることから,目的を変更する薬剤のリスクを正当化できない可能性がある.これは,毒性のリスクが高い患者や,有害事象のために治験への組み入れが不可能な状況では,最も懸念されることである.
ACEはアンジオテンシン変換酵素,ARBはアンジオテンシン受容体遮断薬,COVID-19はコロナウイルス病2019,SARS-CoV-2は重症急性呼吸器症候群コロナウイルス2を示す.
限界
本レビューには留意すべきいくつかの限界がある.第一に,COVID-19の治療に関する公表文献の膨大な量と速いペースは,新しいエビデンスが生じるにつれて,研究の知見と勧告が絶えず進化していることを意味する.第二に,これまでに発表された治療データは,観察データまたは小規模臨床試験(患者数が250人を超える患者はいない)からのみ導き出しており,治療効果の大きさに関してバイアスまたは不正確さのリスクが高いことを導入している.第三に,著者らのレビューは成人患者のみに焦点を当てており,データは小児集団には適用できない可能性がある.第四に,論文は,関連する国際データが不足する可能性があるため,英語の出版物または翻訳に限定されていた.
結論
COVID-19のパンデミックは,この世代,そして潜在的には1918年のパンデミック・インフルエンザ発生以来,世界最大の公衆衛生上の危機となっている.COVID-19の潜在的な治療法を検討するために開始された臨床試験のスピードと件数は,パンデミックの途中でも質の高いエビデンスを生み出す必要性と能力の両方を強調している.現在まで有効性が示されている治療法はない.
いかがでしたか?
JAMAのCOVID-19総説は読み応えがありましたね.
これは4月5日に投稿されています.
まだまだたくさんいろんな論文が出てきます.
こうして医学的知見は積み重ねられて行き
わたしたち医師は科学的根拠に基づいた治療を患者さんに提供します.
ここには決して どんどんPCRやれ とは書かれていないですよね.(昨今の日本のアカデミアの行動に対する皮肉です.)


コメント