アビガン(ファビピラビル)の臨床試験
こちらの論文から.
これは,まだ,第2相の臨床試験です.
臨床試験について少し説明します.
第1相: 少人数の健常者で少量から少しずつ投与量を増やして安全性・毒性について調べたり,血液や尿などの濃度を測定して吸収や代謝をみます.
第2相 効果を示すと予想される比較的少人数の患者さんで,有効性・安全性,投与量・投与間隔・投与期間などをどうしたらよいか、といったことを調べるフェーズです.通常いくつかの投与量を用いて比較検討しますが,その際にプラセボといって何も効果のないものを比較対象に加えるのが一般的です.また現在使われている標準的な薬剤がある場合には、それと比較することもあります.
第3相 多数の患者さんで第2相試験の結果から得られた薬剤の有効性・安全性・投与方法を最終的に確認します.
現在使われている標準的な薬剤がある場合にはそれとの比較、標準的な薬剤がないならばプラセボ(効果も害もない薬剤)との比較が中心になります。
それでは,論文の内容を見ていきましょう.
抄録
中国では、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染症の集団発生とその原因となるコロナウイルス疾患2019(COVID-19)が、2019年12月より報告されている。16%以上の患者が急性呼吸窮迫症候群を発症し、致死率は約1~2%であった。特異的な治療法は報告されていない。ここでは、COVID‐19の治療に対するファビピラビル(FPV)対ロピナビル(LPV)/リトナビル(RTV)の効果を調べた。臨床検査でFPV経口投与(1日目: 1600mgを1日2回;2~14日目: 600mgを1日2回)+エアロゾル吸入(500万Uを1日2回)によるインターフェロン(IFN)-αの併用投与(500万Uを1日2回)を受けた臨床検査で確認されたCOVID-19の患者を本試験のFPV群としたが、LPV/RTV(1~14日目: 400mg/100mgを1日2回)+エアロゾル吸入(500万Uを1日2回)によるIFN-αの併用投与を受けた患者を対照群とした。胸部コンピュータ断層撮影(CT)、ウイルスクリアランス、および薬物安全性の変化を2群間で比較した。FPV群に登録された患者35例および対照群の患者45例については、ベースライン時の特性はいずれも両群間で同等であった。
FPV群では対照群と比較してウイルスクリアランス時間が短かった。また、FPV群は対照群と比較して胸部画像検査で有意な改善を示し、改善率は91.43%対62.22% (P = 0.004)であった。潜在的交絡因子を調整した後、FPVアームは胸部画像診断においても有意に高い改善率を示した。多変量Cox回帰は、FPVがより速いウイルスクリアランスと独立して関連することを示した。さらに、FPV群では対照群よりも副作用が少なかった。この非盲検非無作為化対照試験において、FPVは疾患進行およびウイルスクリアランスの点でCOVID-19に対して有意に良好な治療効果を示した.
——-中略——
2.2. 適格基準
適格基準は
16~75歳の入院例
呼吸器または血液検体で新型コロナウイルス陽性
発症から登録までの期間が7日未満
研究中および治療後7日以内に避妊を希望
および錠剤の嚥下困難なし
とした。
除外基準
重篤な臨床状態
安静時呼吸数が30/分を超え、酸素飽和度が93%未満、酸素飽和度(OI) <300mmHg (1mmHg = 133.3Pa)
呼吸不全
ショックおよび/またはICUのモニタリングおよび治療を必要とする他の臓器の合併不全
慢性肝臓および腎臓疾患
FPVまたはLPV/RTVに対するアレルギー反応の既往歴
妊婦または授乳中の女性
分娩後2週間以内の妊娠可能年齢の女性
現在または過去28日間のSARS-CoV-2治療に対する別の臨床試験に参加した
このうちの1つを満たす
2.3. 治験治療
FPV (1錠あたり200mg)を経口投与した。投与量は、1日目に1600mgを1日2回、2−14日目に600mgを1日2回とされた。LPV/RTV (1錠あたり200mg/50mg)を経口投与した。投与量はLPV 400mg/RTV 100mg 1日2回であった。
ウイルスクリアランスが確認されるまで、または14日が経過するまで、FPVおよびLPV/RTVの両方を継続した。また、全参加者にIFN-α1b 60μg(北京Tri-Prime Gene Pharmaceutical Co.、30μg/ampule)を1日2回エアロゾル吸入投与した。
標準的なケアは、酸素吸入、経口または静脈内補水、電解質補正、解熱剤、鎮痛薬、および制吐薬であった。
2.4. 有効性評価項目
治療の有効性は、ウイルスクリアランスの時期及び治療後14日目の胸部コンピュータ断層撮影(CT)スキャンの改善率により評価した。治療後4、9、14日目に胸部CTスキャンを実施し、変動は2日間とした。CT所見は、以前に記載された方法を用いて、2つの医学によって等級付けされ、スコア付けされた。
3. 結果
3.1. 患者およびベースライン解析
1月30日から、臨床検査でCOVID-19が確認された56人の患者がスクリーニングを受け、そのうち35人が本研究のFPV群に適格であった。2020年1月24日~1月30日にLPV/RTVによる治療を開始した臨床検査で確認されたCOVID-19患者計91例をスクリーニングし、そのうち45例を本試験の対照群に適格とした。登録された患者全員が治療を終了し、治療開始後14日間追跡調査した。すべてのベースライン特性を、FPV群と対照群との間で比較した。両群のベースライン特性間に有意差は認められなかった。
3.2. 抗ウイルス療法に対するウイルス反応
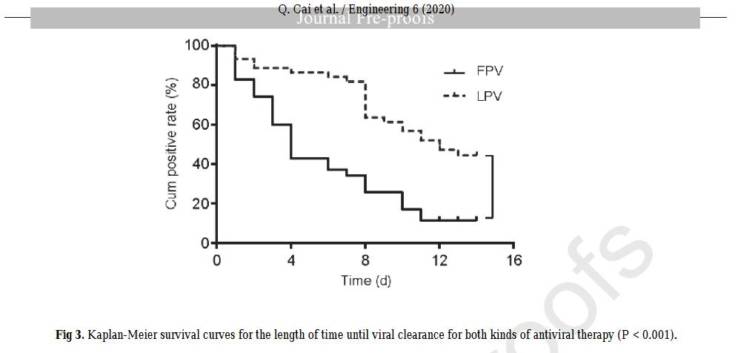
両抗ウイルス療法のウイルスクリアランスまでの期間に関するKaplan-Meier生存曲線を図3に示した。A群として指定されたFPVで治療された患者のウイルスクリアランス時間の中央値は4d (IQR: 2.5~9)と推定され、これはB群としてデザインされた対照群の患者の時間よりも有意に短く、11 d (IQR: 8~13)であった(P <0.001)。
3.3. COVID-19患者の治療反応性における胸部CTの変化
ノンパラメトリックMann-Whitney U検定を用いて、2種類の異なる治療に反応した胸部CT変化の差の有意性を判定した(表2)。一方、試験の2群の胸部CT変化の改善率を治療後4、9、14日目に比較した。4日目および8日目には、両群間で改善率に有意差は認められなかった(P > 0.05)。しかし、治療後14日目に、FPV群における胸部CT変化の改善率は、対照群よりも有意に高かった(91.4%対62.2%,32/35対28/45,P = 0.004)。
4. 考察
本研究では、COVID-19の治療に対するFPV対LPV/RTVの効果を検討した。FPVは、より速いウイルスクリアランスおよび胸部画像診断におけるより高い改善率と独立して関連することが分かった。これらの所見は、FPVがLPV/RTVと比較して、疾患進行およびウイルスクリアランスの点でCOVID-19に対する有意に良好な治療効果を有することを示唆している。プロドラッグとして知られるFPVは新規RNA依存性RNAポリメラーゼ(RdRp)阻害薬であり、インフルエンザやエボラウイルスの治療に有効であることが示されている。近年、Wangらの報告では、FPVとレムデシビルの両方が試験管内でSARS-CoV-2感染を減少させるのに効果的であることが示された(EC50= 61.88μmol ·L−1, CC50 > 400μmol ·L−1、SI > 6.46)。事前に設定した研究の所見は、FPVがCOVID-19に対して有効な治療法であるという臨床検査所見から考えられる仮説を確認するものである。
今回の研究の限界は、無作為化二重盲検プラセボ対照臨床試験ではなかったことであり、患者募集に必然的な選択バイアスが生じたことである。しかしながら、同時に発症する患者数が多く、本疾患の感染性が非常に高いことを考慮すると、患者の大部分が理解することが不可能なランダム化プロセスを用いて、異なる試験薬を投与するように患者を割り付けることは倫理的に許容できなかった。さらに、風評や病院隔離への不信との関連では、最初にランダム化デザインを用いたことで、さらに多くの患者が隔離を拒否した可能性がある。そこで、2つの別々の期間に連続して入院した患者をそれぞれ2群に含めた非ランダム化試験を実施することとした。重要なことに、2群の全てのベースライン特性は同等であり、FPVの有効性は潜在的交絡因子の調整後も有意なままであった。
今回の試験では、早期のウイルスクリアランスが14日目の胸部画像検査の改善に寄与していることも明らかになった。この所見は、疾患の改善がSARS-CoV-2の阻害に依存する可能性があり、FPVがSARS-CoV-2を阻害することによってCOVID-19の疾患進行を制御することを示唆している。最近まで、COVID-19の病原体は十分に解明されていなかった。SARS-CoV-2の感染は自己限定性で全身性炎症反応を特徴とすると考えられたため、WHOおよびPRCのNational Health Commissionにより対症療法および支持療法が主に推奨された。この記述はMERS-CoVに類似しており、重度の罹病および死亡を予防するために非特異的な治療的介入がしばしば導入される。抗ウイルス薬がこの疾患の制御にどのように寄与するかは議論の余地がある。COVID-19に対する抗ウイルス薬に焦点を当てた登録臨床試験は数多く行われているが、投与時期、投与期間、試験のエンドポイントは統一されていない。今回の研究では、FPVのSARS-CoV-2に対する抗ウイルス効果を評価し、FPVの優先順位をうまく同定するために、主要評価項目としてウイルスクリアランスの時期を導入した。ウイルスクリアランスの時間とCT画像の改善との関係は、ウイルスクリアランスが臨床エンドポイントの理想的な代替指標であることを示している。本研究の限界は、ウイルス力価と臨床予後との関係が十分に明らかにされていないことであった。今後の研究では、この点により多くの注意を払うことができるであろう。
なお、本試験におけるFPVの投与期間は、インフルエンザの治療に用いられた期間の2倍であったことは言及する価値がある。しかし、実験群の有害事象はまれであり、忍容性があり、FPV治療を中止する必要があった患者はいなかった。これらの結果は、必要であればFPVの治療期間を延長できることを示唆していると思われる。
SARS-CoV-2感染は現在、世界中で急速に広がっている。現在のところ、有効な治療法は実証されていない。当面の課題は、高レベルのエビデンスに基づいて効果的な治療法を同定するために、適切にデザインされた試験を実施することであった。しかしながら、この研究の開始時には、特定の条件によって、患者が標準治療または実験的薬剤のいずれかを受けるようにランダム化されることはできなかった。非無作為化対照試験のこのパイロット試験では、FPVが疾患進行およびウイルスクリアランスの点でCOVID-19に対する有意に良好な治療効果を示したことがわかった.
アビガンの期待度
効果的な薬剤がない中,非常に期待できると思います.
ただ,これは 入院が必要な 症例に対して限定的に行われた第2相試験で,症例数も少なく,本来はまだまだ 患者さんに還元出来る エビデンスレベルでは全くありません.
しかし.
新興感染症の場合,『ない』ところから始まりますので,あまり普段の治療選択の科学的正当性を検証してからどうのこうのと言ってる場合でもないので
こうして出てくるものを見ながら,ってことになると思います.
最近,感染性のあるウイルスを排出している期間は症状発症から7日という論文も出てきたので,投与期間14日という用法については議論の余地があるように感じます.
また,適格基準にADLに関することが全く入っていないのですが,これはちょっと癌の分野の臨床試験を見慣れているわたしからすると,慣れない光景です.


コメント