『天下りしてないからアビガン承認遅い』は本当か?
アビガンが認可されないのは『早い話が厚労省の本音は「富山化学なんて天下りもしていないし」ということにあるという事実が浮かび上がってきたのです。』と書いた自民党参議院議員青山繁晴さんのブログの虚偽について切り込んでみましょう.議員なのにこんな嘘ばっか言って困った人だと思います.護る会の会長??何を護ってるんだ??というのがわたしの結論です.以下,よくご覧ください.
shiaoyama.com/essay/detail.php?id=1758
ブログのリンクはこちら.
リンク先に行かなくても見れるようにこちらにも上げときますね.
わたし,今日,青山さんの政策秘書のIさんに電話して,言いましたよ.
何がまもる会だ?
コロナと寝ずに戦っている厚生労働省を貶めて守る日本の国益なんてない!
いったい何を護ってるんだ?!
この野郎!って伝えてよ.
秘書さんは マイルド に伝えると言ってましたが.
HPをFAXするので無駄ですよ.(笑)
それでは,薬の承認の過程について見ていきましょう.
薬の承認は何で決まっているのか?
薬の承認は薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)で規定されています.
elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=335AC0000000145#156
第一条 この法律は、医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品(以下「医薬品等」という。)の品質、有効性及び安全性の確保並びにこれらの使用による保健衛生上の危害の発生及び拡大の防止のために必要な規制を行うとともに、指定薬物の規制に関する措置を講ずるほか、医療上特にその必要性が高い医薬品、医療機器及び再生医療等製品の研究開発の促進のために必要な措置を講ずることにより、保健衛生の向上を図ることを目的とする。
それでは,レムデジビルremudesivir(RDV)はどうしてファビピラビルFPV(アビガン)より審査の過程が早いのでしょうか???
そもそも我が国にある薬なのにいったい何やってんだ???
『知らない人』はこう思っちゃいそうですよね.
しかし.青山さんは国会議員ですので,法律を作る側ですし,政策秘書もいるので法律知らずに陰謀論を述べるのは知性が高くないことを喧伝する効果があることに注意すべきでしょう.
政策秘書のかたは,いったい何をやってるんですかね?????
レムデジビルの場合
レムデジビルはFDAがすでに認可しています.
こういう医薬品を緊急で日本で使用するための手続きとして
薬機法第十四条の三 第十四条の承認の申請者が製造販売をしようとする物が、次の各号のいずれにも該当する医薬品として政令で定めるものである場合には、厚生労働大臣は、同条第二項、第五項、第六項及び第八項の規定にかかわらず、薬事・食品衛生審議会の意見を聴いて、その品目に係る同条の承認を与えることができる。
一 国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その他の健康被害の拡大を防止するため緊急に使用されることが必要な医薬品であり、かつ、当該医薬品の使用以外に適当な方法がないこと。
二 その用途に関し、外国(医薬品の品質、有効性及び安全性を確保する上で我が国と同等の水準にあると認められる医薬品の製造販売の承認の制度又はこれに相当する制度を有している国として政令で定めるものに限る。)において、販売し、授与し、又は販売若しくは授与の目的で貯蔵し、若しくは陳列することが認められている医薬品であること。
2 厚生労働大臣は、保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、前項の規定により第十四条の承認を受けた者に対して、当該承認に係る品目について、当該品目の使用によるものと疑われる疾病、障害又は死亡の発生を厚生労働大臣に報告することその他の政令で定める措置を講ずる義務を課することができる。
このように決まっています.
これ.海外の薬を早く使えるようにしてよ,という声にこたえて早く審査する,という例でもありません.
全く通常ではない事例ですよ.
だって『国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その他の健康被害の拡大を防止するため緊急に使用されることが必要』なわけですから.
前に発動されたのは,『新型インフルエンザ』のワクチンを海外から輸入するときです.
ここからどのようにどこで審査されるのか?
www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000072285.pdf
薬事分科会の第2部会というところで審議されて承認されるという手続きになります.
通常の新薬の承認手続きはどうなっているのか?
これはPMDAのHPにあります.
www.pmda.go.jp/review-services/drug-reviews/about-reviews/p-drugs/0014.html
1.通常の場合
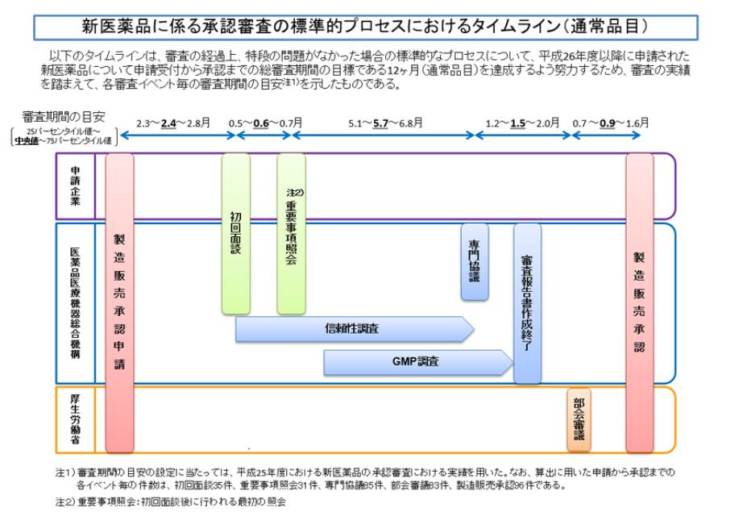
2.急ぎたい場合
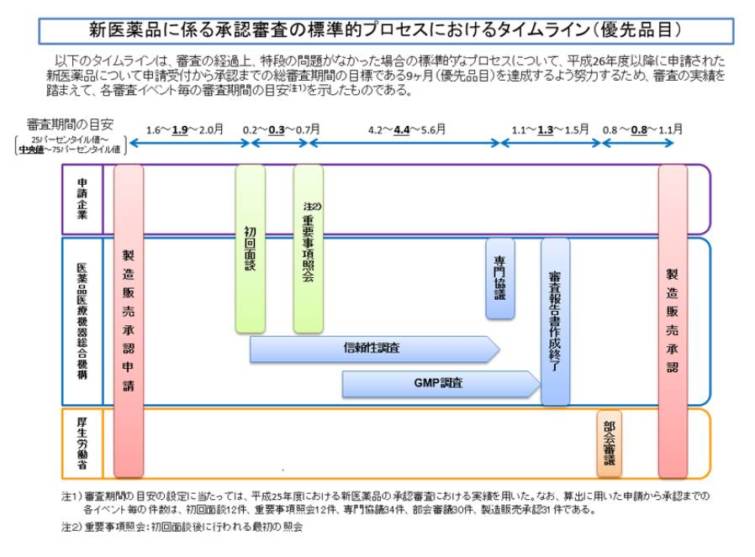
特例審査は何が違うのか?
まず,関係法規でどう決まっているのかを見ていきましょう.
elaws.e-gov.go.jp/search/elawsSearch/elaws_search/lsg0500/detail?lawId=336M50000100001#446
薬機法施行規則
(特例承認に係る医薬品の承認申請書に添付すべき資料の提出の猶予)
第四十一条 厚生労働大臣は、申請者が法第十四条の三第一項の規定による法第十四条の承認を受けて製造販売しようとする医薬品について、前条第一項第一号イからヘまで及びチに掲げる資料を添付することができないと認めるときは、相当の期間その提出を猶予することができる。
では,どんな資料の提出を猶予されているのでしょうか?
薬機法施行規則
第四十条 法第十四条第三項(同条第九項において準用する場合を含む。)の規定により第三十八条第一項又は第四十六条第一項の申請書に添付しなければならない資料は、次の各号に掲げる承認の区分及び申請に係る医薬品、医薬部外品又は化粧品の有効成分の種類、投与経路、剤型等に応じ、当該各号に掲げる資料とする。
一 医薬品についての承認 次に掲げる資料
イ 起原又は発見の経緯及び外国における使用状況等に関する資料
ロ 製造方法並びに規格及び試験方法等に関する資料
ハ 安定性に関する資料
ニ 薬理作用に関する資料
ホ 吸収、分布、代謝及び排泄せつに関する資料
ヘ 急性毒性、亜急性毒性、慢性毒性、遺伝毒性、催奇形性その他の毒性に関する資料
ト 臨床試験等の試験成績に関する資料
チ 法第五十二条第一項に規定する添付文書等記載事項に関する資料
『イからヘまで及びチに掲げる資料』の提出が猶予されているわけなので,対象外なのは 『 ト 臨床試験等の試験成績に関する資料 』だけになります.
そしてこれは 日本語でなければならない という規定はありませんので,乱暴ですが,FDAが認めたよ,という証拠(さっき出したPDF)と
FDAが認可するときの臨床試験データを最悪英語で提出すればよい,ということになります.
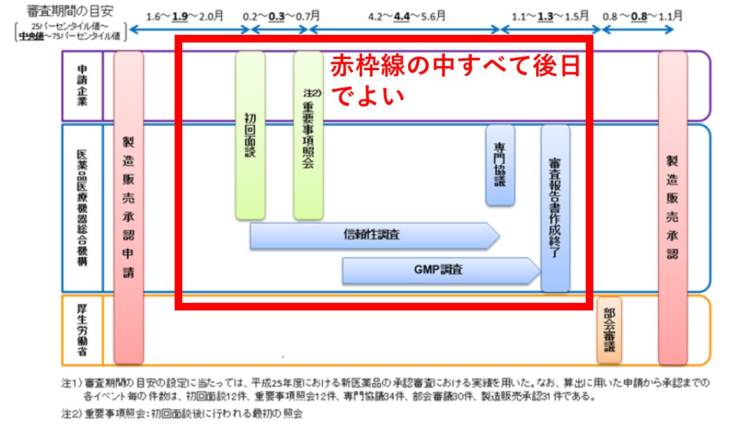
要するに
承認申請 ⇒ いきなり数日後に厚生労働省で『部会』 ⇒ 承認
という非常に簡素化された手続となっています.
部会ってなあに?
これもですねえ.非常にマニアックですが決まりがありまして.
www.mhlw.go.jp/file/05-Shingikai-11121000-Iyakushokuhinkyoku-Soumuka/0000072285.pdf
薬事分科規定という規定で決まっています.
RDVは感染症の薬剤なので,医薬品第二部会が担当します.
というわけで
RDVの認可は最短で申請から3日で降りることとなります.
特例措置ってずっとつづくの?
これも薬機法に規定があります.
(特例承認の取消し等)
第七十五条の三 厚生労働大臣は、第十四条の三第一項(第二十条第一項において準用する場合を含む。以下この条において同じ。)、第二十三条の二の八第一項(第二十三条の二の二十第一項において準用する場合を含む。以下この条において同じ。)又は第二十三条の二十八第一項(第二十三条の四十第一項において準用する場合を含む。以下この条において同じ。)の規定による第十四条、第十九条の二、第二十三条の二の五、第二十三条の二の十七、第二十三条の二十五又は第二十三条の三十七の承認に係る品目が第十四条の三第一項各号、第二十三条の二の八第一項各号若しくは第二十三条の二十八第一項各号のいずれかに該当しなくなつたと認めるとき、又は保健衛生上の危害の発生若しくは拡大を防止するため必要があると認めるときは、これらの承認を取り消すことができる。
というわけで
1.他の薬などがでたのでもうなくても大丈夫
2.使用してみたら重篤な有害事象がたくさん出た
とか言う場合にこの特例措置は解除されます.
ファビピラビルFPV(アビガン)の場合
アビガンは一度インフルエンザで承認申請されてすでに承認が下りている薬剤です.
今回,COVID-19に対して使用するには,『効能追加(適応症の拡大)』という手続きとなります.
手続き規定は?
これに関してはやっぱり薬機法にあります.(もうそろそろお腹いっぱいよーーー(ToT))
薬機法第14条
9 第一項の承認を受けた者は、当該品目について承認された事項の一部を変更しようとするとき(当該変更が厚生労働省令で定める軽微な変更であるときを除く。)は、その変更について厚生労働大臣の承認を受けなければならない。この場合においては、第二項から前項までの規定を準用する。
要するに,『今ある薬だから』といって,ほかの疾患に勝手に使っていいわけではありません.
効能追加するためにはどうするのか?
RDVのところで紹介した一般薬の手続きがなされます.
RDVは特例措置なので後日でよかった書類がFPVの場合は全部必要になります.
でも安全性とか確認されてんだから早いんじゃね?
いえいえ.インフルエンザの場合と用法容量が違うんです.
だから,まじめに第3相試験をやって有効性や有害事象を見てみないといけないんです.
第1相試験では薬物動態(吸収・分布・代謝・排泄)や安全性(有害事象)について検討します.
第2相試験では比較的少数例を対象に有効性・安全性などの検討を行います.
第3相試験では上市後に実際にその化合物を使用する患者を対象として有効性・安全性の検討をより大きな規模で行います.
報道されている通り,3月からこの臨床試験が開始しています.
新薬なので対照がなく,おそらくプラセボを対象として比較的軽症例で行われていると思います.
5月中に承認できるって本当?
これはですねえ...
臨床試験の結果自体が出るのはもっと先なんだけど,
安倍総理が5月中の承認を目指すようにとはっぱっけたので
もう~,めっちゃ現場大変ですよ.
中間解析で有効性が確認されたらいいんじゃね? みたいな感じかな.想像するに.
とーころが.
臨床試験のデーターあげる医療機関側が今,手一杯ですよね.
そんなに早くデータ集まるのかな?
こっちも一生懸命お尻叩かないといけないんじゃないかな??
(笑)
わたしも,昔,がんの分野で報告書書いてましたからね!
というわけで
なぜアメリカの薬であるレムデシビルが早く承認されて
日本の薬であるファビピラビルが遅くなるのかについて,ご理解いただけました?
そこには何の陰謀もありません.
ましてや厚生労働省から天下りしていないせいではありません.
こんなことを厚生労働省に言う青山さん.
是非反省して,お勉強してください.
大体
青山さんの政策秘書何やってんですか?
秘書ならあるじが変なことしてないかちゃんとチェックして
青山さんが恥をかないようにしろよ.
青山さん.なんでも陰謀説唱えてると,議員としてどうなのよと思われますよ.
青山さんが 自分と握手したらがんが治る と言ったと主張している人たちについて
大変ついでにこれをやりましょう.
#青山繁晴 さんが 握手でがんが治ったと言っている と主張している人たち.
この動画をみよ!
ちなみに,洋美ちゃんはがん専門医ですが
青山さんががんをなおしてくれるなら青山さんの靴はまったく躊躇なくなめて,患者を治してもらいたいよ.わたしたちは死神と戦って必ず敗けるので.
— 仲田洋美 遺伝専門医【専門医制度周辺調整中】 (@drhiromi) May 5, 2020
といっても.ツイート見てねって程度ですが.
わたしは是々非々なので.
一つ一つの事例で内容を検討するだけです.
青山さんのお人柄とかバックグラウンドは存じませんのと,存じていても何の考慮も致しません.
吾輩の辞書に ソンタク はありませんので.
青山さんが護る会の会長で,文化人放送局に一緒に出演してた長尾先生が副会長らしくて.
全然知らなかったけど.
日本の国益を本当に守りたいのであれば
ありもしない陰謀論を唱えるのではなく
真面目に勉強してほしい,というのが私の希望です.
わたしは長尾先生は本当に尊敬していたのですが.
青山さんの信者たちが長尾先生にまで攻撃したようにまた聞きしているので
もう長尾先生とも袂を分かちました.(一方的にですよ.私が.)
わたしたち二人の間のことではなく
関係ない青山さんの件でこんな日が来るとは思いませんでしたが.
ご自分の影響力を考慮できない議員ってことでしょうか?
もう少し責任をもって行動なされてはいかがかなと思います.
以上
**********************
いかがでしたか?
ちょっと
面倒な内容でしたが.
ついてこれたかな?(笑)


コメント