目次
Nature Microbiology volume 5, 1185–1191 (2020)
www.nature.com/articles/s41564-020-00789-5
和訳文中の数字はリファレンス論文の番号です。著者名含めて、原文サイトでご確認ください。
論文タイトル
抗体依存的感染増強とSARS-CoV-2のワクチンおよび治療法
概要
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する抗体医薬品およびワクチンは、前臨床および臨床開発が急がれている。SARS-CoVと他の呼吸器系ウイルスの研究から得られたデータは、抗SARS-CoV-2抗体が、抗体依存性感染促進(ADE;antibody-dependent enhancement)によりCOVID-19を悪化させる可能性を示唆している。これまでのRSウイルスやデング熱ウイルスのワクチン研究では、抗体依存性感染促進ADEに関連したヒトの臨床安全リスクが明らかになり、ワクチン試験が失敗に終わっている。ここでは、主要な抗体依存性感染促進ADEのメカニズムを説明し、開発中のSARS-CoV-2ワクチンおよび治療薬の緩和戦略について議論する。また、SARS-CoV-2に対する抗体ベースの防御のリスクと機会を評価するために、最近発表されたデータを紹介する。
主な内容
コロナウイルス2019(COVID-19)の原因ウイルスである重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)の出現と急速な世界的拡大は、世界的に大きな罹患率と死亡率をもたらし、社会的・経済的な混乱が広がっている。SARS-CoV-2は、2002年に発生したSARSの原因となったSARS-CoVと近縁のベータコロナウイルスである(約80%の配列同一性を有する)。その次に近いヒトコロナウイルスの親戚は、2012年に中東呼吸器症候群を引き起こした中東呼吸器症候群関連コロナウイルス(MERS-CoV、~54%の配列同一性)である(参考文献1,2)。SARS-CoV-2は、より軽度の感染症を引き起こす他のヒトコロナウイルスとも遺伝的に関連している。HCoV-HKU1(~52%の配列同一性)、HCOV-OC43(~51%)、HCOV-NL63(~49%)、HCOV-229E(~48%)1。SARS-CoV-2は、カブトコウモリで同定されたコロナウイルスとさらに近縁であることから、カブトコウモリが主要な動物のリザーバーであり、パンゴリンでは中間的な感染経路の可能性があることが示唆されている3。
SARS-CoV-2の細胞侵入は、ウイルスのスパイク(S)タンパク質が細胞内の受容体であるアンジオテンシン変換酵素2(ACE2)に結合することによって行われる4,5。他にも、ニューロピリン-1(参考文献6,7)や、Sタンパク質の成熟に関与する膜貫通型セリンプロテアーゼであるTMPRSS2などの宿主侵入因子が同定されている4。SARS-CoV-2のSタンパク質は、受容体結合ドメイン(RBD)を含むS1サブユニットと、ウイルス侵入のための膜融合を媒介するS2サブユニットから構成されている8。ワクチンや治療薬の開発における主要な目標は、ACE2-RBD結合相互作用またはSタンパク質による膜融合を阻害することで、SARS-CoV-2の細胞への侵入を防ぐ抗体を作製することである。
抗体ベースのワクチンや治療薬の潜在的なハードルの1つは、抗体依存性感染促進(ADE)によってCOVID-19の重症度を悪化させるリスクである。抗体依存性感染促進ADEは、呼吸器合胞体ウイルス(RSV)9,10や麻疹11,12など、他の呼吸器ウイルスを含む複数のウイルス感染症の重症度を高める可能性がある。呼吸器感染症における抗体依存性感染促進ADEは、サイトカインカスケードや細胞介在性免疫病理など、抗体を介さないメカニズムを含む、より広いカテゴリーである「増強呼吸器疾患(ERD;enhanced respiratory disease)」に含まれる(box1)。ウイルス複製の促進によるADEは、デングウイルス13,14や猫伝染性腹膜炎ウイルス(FIPV)15など、マクロファージに感染する他のウイルスでも観察されている。さらに、SARS-CoVやMERS-CoVでは、in vitroおよびin vivoでADEと増強呼吸器疾患ERDが報告されている。ADEがCOVID-19の免疫病理にどの程度寄与しているのか、活発に研究されている。
この展望では、SARS-CoV-2におけるADEのメカニズムの可能性を議論し、ワクチンや治療薬のリスク軽減の原則をいくつか紹介しています。また、COVID-19の病態における抗体依存性感染促進ADEの関連性を明らかにする可能性のある研究を取り上げ、新たなデータが臨床的介入にどのように影響するかを検討する。
増強呼吸器疾患ERDは、医療介入(特にワクチン)に関連した呼吸器系ウイルス感染症の重篤な臨床症状を示す。増強呼吸器疾患ERDは、医療介入(特にワクチン)に関連した呼吸器系ウイルス感染症の重篤な臨床症状を指すが、自然感染でも同様の症状が現れることがあるため、前臨床試験や臨床試験では、医療介入群とプラセボ群の重篤度分布を比較することにより、増強呼吸器疾患ERDが検出される。増強呼吸器疾患ERDは、FcR依存性の抗体活性と補体活性化(すなわち抗体依存性感染促進ADE)をはじめ、組織細胞死、サイトカイン放出、局所免疫細胞活性化などの抗体非依存性のメカニズムなど、幅広い分子メカニズムと関連していると考えられる。
抗体依存性感染促進ADEは、関与する分子メカニズムに基づいて、2つの異なるタイプに大別される。
1.感染促進による抗体依存性感染促進ADE。
Fc-FcR相互作用を介した抗体依存的な方法で、標的細胞への感染率が高まる。感染促進による抗体依存性感染促進ADEは、単球やマクロファージなどのFcγRIIaを発現する細胞への抗体依存性感染を検出するin vitroアッセイを用いて一般的に測定される。しかし、in vitro ADE試験の結果と臨床的有用性との関連性は、直接観察されるというよりは、暗示されることが多い。デングウイルスは、感染の促進による臨床的なADEの最も優れた記録例である。
2.免疫活性化の促進による抗体依存性感染促進ADE。
強化された疾患および免疫病理は、抗体依存的に過剰なFcを介したエフェクター機能および免疫複合体形成によって引き起こされます。強化された疾患に関連する抗体は、しばしば非中和性である。このタイプの抗体依存性感染促進ADEは、通常、免疫病理や炎症マーカーを含む疾患症状の悪化を検出することによってin vivoで調べられ、呼吸器系ウイルス感染との関連が最も明確になっている。RSVや麻疹は、免疫活性化によって引き起こされる抗体依存性感染促進ADEの例としてよく知られている。
増強呼吸器疾患ERDや抗体依存性感染促進ADE(上記の第2のタイプ)は、重篤な疾患を引き起こす特定の分子メカニズムではなく、症状の有病率や疾患の重症度などの臨床データによって特定されることが多い。免疫系の異なる組織間に複雑なフィードバックループが存在するため、たとえ抗体依存性感染促進ADEや増強呼吸器疾患ERDを裏付ける臨床データが明確であっても、ヒトや動物を用いた研究でADEや増強呼吸器疾患ERDの分子メカニズムを決定的に解明することは(不可能ではありませんが)非常に困難である。ADEおよびERDの追跡には、多くの異なる測定法やアッセイが用いられており、これらは、特定のウイルス、前臨床および/または臨床プロトコル、採取された生物学的サンプル、使用されたin vitro技術に基づいて変化する可能性がある。
呼吸器系の抗体依存性感染促進ADEは、増強呼吸器疾患ERDの特定のサブセットである。
抗体依存性感染促進ADEのメカニズム
1つは、抗体を介したウイルスのFcγ受容体IIa(FcγRIIa)発現食細胞への取り込みが促進され、ウイルスの感染および複製が増加すること、もう1つは、抗体のFcを介したエフェクター機能または免疫複合体形成が過剰になり、炎症および免疫病理が促進されることである(図1、ボックス1)。いずれの抗体依存性感染促進ADE経路も、中和しない抗体や中和レベル以下の抗体がウイルス抗原に結合しても、感染を阻止したり除去したりすることができない場合に起こりうる。抗体依存性感染促進ADEは、in vitroアッセイ(FcγRIIaを介した食細胞への感染促進を伴う第一のメカニズムで最も一般的)、免疫病理学、肺病理学など、いくつかの方法で測定することができます。FcγRIIaを介した食細胞へのエンドサイトーシスを介した抗体依存性感染促進ADEは、in vitroで観察することができ、ヒトのデングウイルス16やネコのFIPV15など、マクロファージトロピックなウイルスについて広く研究されている。このメカニズムでは、中和しない抗体がウイルスの表面に結合し、ウイルスを直接マクロファージに輸送し、マクロファージがウイルスビリオンを内包して感染し、ウイルスを再生産(複製)する。異なるデング熱血清型に対する多くの抗体は交差反応性を示すが中和されないため、異種株による二次感染はウイルスの複製を増加させ、より重篤な疾患を引き起こす可能性があり、最近のデングワクチン試験で報告されたように大きな安全性リスクにつながる。他のワクチン試験では、FIPVのSタンパク質を免疫した猫や、抗FIPV抗体を受動的に注入した猫は、FIPVにチャレンジした際の生存率が対照群に比べて低かったとされている17。中和しない抗体、あるいは中和以下のレベルの抗体は、肺胞マクロファージや腹膜マクロファージへの侵入を促進し18、感染を拡散させ、疾患の転帰を悪化させると考えられた19。
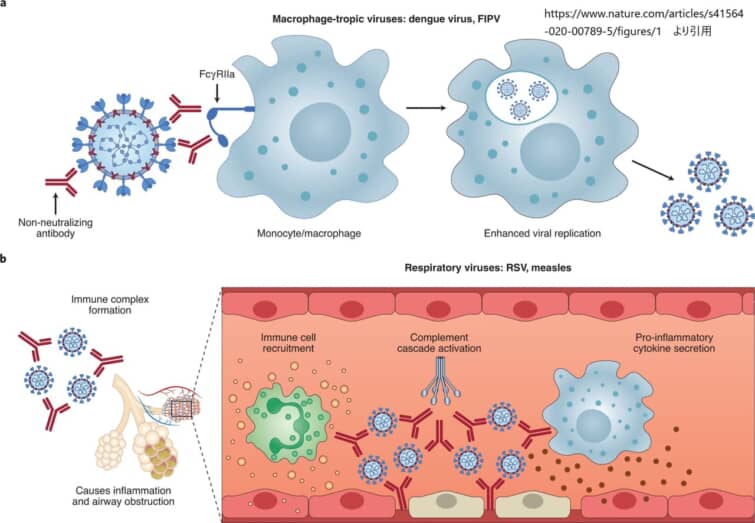
図1:ウイルス性疾患における2つの主要な抗体依存性感染促進ADEメカニズム。
a, デングウイルスやFIPVのようなマクロファージトロピックなウイルスの場合、非中和抗体や亜中和抗体は、FcγRIIaを介したエンドサイトーシスにより単球やマクロファージへのウイルス感染を亢進させ、その結果、より重篤な疾患を引き起こす。b. RSVや麻疹などのマクロファージを経由しない呼吸器系ウイルスの場合、中和しない抗体は気道組織内でウイルス抗原と免疫複合体を形成し、炎症性サイトカインの分泌、免疫細胞の動員、肺組織内の補体カスケードの活性化を引き起こす。その結果、炎症性サイトカインの分泌、免疫細胞の動員、肺組織内の補体カスケードの活性化が起こり、続く炎症が気道の閉塞を引き起こし、重症の場合は急性呼吸困難症候群を引き起こす可能性がある。COVID-19の免疫病理学的研究は現在も進行中であり、最新のデータでは、SARS-CoV-2によるヒトマクロファージの感染は非生産的であることが示唆されている。既存のエビデンスによれば、COVID-19の免疫病理における最も可能性の高い抗体依存性感染促進ADEメカニズムは、免疫複合体形成、補体沈着、局所免疫活性化である。図はBioRender.comで作成した。
呼吸器系病原体で最もよく例示される2番目の抗体依存性感染促進ADEメカニズムでは、Fcを介した抗体のエフェクター機能は、観察可能な肺の病理学的結果をもたらす強力な免疫カスケードを開始することにより、呼吸器系疾患を促進することができる20,21。単球、マクロファージ、好中球、樹状細胞、ナチュラルキラー細胞などの局所的および循環的な自然免疫細胞のFc媒介による活性化は、ウイルスに感染した細胞や破片の除去に有効であるにもかかわらず、免疫活性化の調節不全を引き起こす可能性がある。RSVや麻疹などのマクロファージに感染しない呼吸器ウイルスの場合、非中和抗体は、気道組織に沈着する免疫複合体を形成し、サイトカインおよび補体経路を活性化することで抗体依存性感染促進ADEおよび増強呼吸器疾患ERDを誘発し、その結果、炎症、気道閉塞を引き起こし、重症の場合は急性呼吸窮迫症候群を引き起こすことが示されている10,11,22,23。RSVと麻疹による抗体依存性感染促進ADEのこれらの先行研究は、既知のCOVID-19の臨床症状と多くの類似点があります。例えば、COVID-19やSARSでは、補体カスケードの過剰活性化が炎症性肺傷害の原因となることが示されている24,25。最近行われた2つの研究では、COVID-19患者のSおよびRBD特異的な免疫グロブリンG(IgG)抗体は、Fcドメイン内のフコシル化レベルが低いことが明らかになった26,27。この親和性の高さは、FcγRIIIaを介したエフェクター機能の活発化28,29を通じて有益な場合もあるが、デングウイルスに対する非中和IgG抗体がアフコシル化されていると、より重篤な疾患の転帰と関連していた30。Larsenらはさらに、COVID-19と急性呼吸窮迫症候群の両方を発症した患者のS特異的IgGは、無症状または軽度の感染症を発症した患者と比較して、フコシル化のレベルが低いことを示している26。SARS-CoV-2特異的抗体のフコシル化レベルの低下がCOVID-19の免疫病理に直接寄与しているかどうかは、まだ明らかになっていない。
重要なのは、SARS-CoV-2がマクロファージに生産的に感染することは示されていないことである31,32。以上のことから、COVID-19の病態に関連する抗体依存性感染促進ADEのメカニズムとして最も可能性が高いのは、抗体-抗原の免疫複合体が形成され、肺組織の免疫カスケードが過剰に活性化されることであると考えられる(図1)。
インビトロのコロナウイルス感染症における抗体依存性感染促進ADEの証拠
抗体依存性感染促進ADEは、ヒト免疫不全ウイルス(HIV)33,34、エボラ出血熱35,36、インフルエンザ37、フラビウイルス38など、多くのウイルスについてin vitroでよく報告されているが、ヒトコロナウイルスに対するin vitroでの抗体依存性感染促進ADEの関連性はあまり明らかになっていない。いくつかの研究では、SARS-CoVやMERS-CoVのウイルス粒子が、in vitroでFcRを発現した単球やマクロファージに取り込まれる量が増加することが示されている32,39,40,41,42。Yipらは、FcγRIIaと抗S血清抗体を介して、SARS-CoVとS発現シュードウイルスの単球由来マクロファージへの取り込みが促進されることを発見した32。同様に、Wanらは、MERS-CoVのRBDに対する中和モノクローナル抗体(mAb)が、FcγRIIaをトランスフェクトしたマクロファージや各種細胞株へのビリオンの取り込みを増加させることを示した39。しかし、抗原特異的な抗体が食細胞への取り込みを促進するという事実は、単球やマクロファージがFcγRIIaを介した抗体依存性の食作用を媒介して、インフルエンザをはじめとするウイルスの除去を行うことができることから、当然のことである43。重要なのは、感染したマウスのマクロファージが、SARS-CoVの抗体を介したクリアランスに貢献したことである44。MERS-CoVはマクロファージに生産的に感染することが確認されているが45、SARS-CoVのマクロファージへの感染は一時的であり、抗体依存的に取り込まれた後の炎症性サイトカインの遺伝子発現プロファイルに変化は見られない41,42。これまでの知見では、マクロファージがSARS-CoV-2感染の生産的宿主であることは否定されている31,32。
ヒトコロナウイルス感染症における抗体依存性感染促進ADE
ヒトのコロナウイルス感染症における抗体依存性感染促進ADEの決定的な役割は確立されていない。セロコンバージョンおよび中和抗体反応が、臨床的重症度および死亡率と相関していることが明らかになったとき、SARS患者の抗体依存性感染促進ADEに対する懸念が初めて示された46。COVID-19患者においても同様の結果が報告されており、SARS-CoV-2に対する抗体価が高いほど重症化することがわかっています47。一つの単純な仮説として、COVID-19の重症患者の抗体価が高いのは、ウイルス量が多いために抗原への曝露時間が長くなっているからだと考えられている48,49。しかし、最近の研究では、上気道へのウイルス排出は、無症候性COVID-19患者と症候性COVID-19患者で区別できないことが示された(参考文献50)。症状のある患者は、より高い抗SARS-CoV-2抗体価を示し、上気道からウイルスをより早く除去した。これは、抗体価は単にウイルス量が多いために生じるという単純な仮説と矛盾する。他の研究では、抗SARS-CoV-2 T細胞反応は、軽度で無症状の感染症でも高レベルで見られることが示されている51,52。これらのデータを総合すると、強いT細胞応答は幅広い臨床症状の患者に見られるが、強い抗体価は重症のCOVID-19とより密接に関連していることが示唆される。重要な注意点として、ウイルスの排出量は下気道ではなく上気道で測定されたことが挙げられる50。COVID-19の重症化には下気道の方が重要である可能性が高く、上気道と下気道におけるSARS-CoV-2ウイルスの排出量が、病気の経過を通じてどの程度密接に相関しているかは不明である。
SARS-CoV-2の新規感染に対する宿主の反応だけでなく、COVID-19患者の抗体依存性感染促進ADEを媒介する、他のヒトコロナウイルス株に対する既存の抗体の可能性も懸念されます53。ヒト集団に常在するコロナウイルス株(HKU1、OC43、NL63、229Eなど)によって誘発される抗体は、ウイルスが中和されていない状態でSARS-CoV-2の交差反応性認識を促進することで、理論的には抗体依存性感染促進ADEを媒介する可能性がある。予備的なデータによると、季節性ヒトコロナウイルス株に高い反応性を示したSARS-CoV-2ナイーブなドナーの抗体は、SARS-CoV-2のヌクレオキャプシドとS2サブユニットに対して低いレベルの交差反応性を示すことがわかった(参考文献54)。このような交差反応性のある抗体が、SARS-COV-2の臨床的ADEに寄与するかどうかは、まだ不明である。
訳者注:セロコンバージョンと交差反応性に関する研究によると、セロコンバージョンを検査した場合、他のヒトコロナウイルスからの交差反応はほとんどないことがわかっている。
SARS-CoV-2ワクチンの増強呼吸器疾患ERDのリスク
SARS-CoV-2ワクチンの安全性に関する懸念は、当初、SARS-CoVワクチンを接種した動物がウイルスチャレンジ後に免疫病理の亢進(増強呼吸器疾患ERD)を示したマウス研究によって高まった55,56,57,58。観察された免疫病理は、Th2細胞に偏った反応55と関連しており、主にヌクレオカプシドタンパク質に対するものであった56,58。重要なことは、ヌクレオカプシド特異的な免疫血清を受動的に移すと、チャレンジしたマウスに免疫病理が観察されなかったことである56。これは、移された血清の量では、増強された疾患が再現されないことを裏付けている。SARS-CoVやMERS-CoVの不活化全ウイルスまたはウイルスベクターベースのワクチンを用いた同様の研究では、ウイルスチャレンジ後に免疫病理が見られ59,60,61、Th2サイトカインに偏った反応55や肺への好酸球の過剰な浸潤57と関連していた。合理的なアジュバントの選択は、Th1細胞に偏った反応を確実にすることで、ワクチン関連の増強呼吸器疾患ERDリスクを著しく低減することができる。ミョウバン、CpG、Advax(デルタイヌリンベースのアジュバント)のいずれかで製剤化したSARS-CoVワクチン候補では、ミョウバンによるTh2偏向反応がマウスの肺好酸球性免疫病理を引き起こしたのに対し、Advaxでは免疫病理を伴わない保護と、よりバランスのとれたTh1/Th2反応が誘導された62。Hashemらは、MERS-CoV S1を発現させたアデノウイルス5ウイルスベクターを接種したマウスは、防御効果があるにもかかわらず、ウイルスチャレンジ後に肺の病理症状を示すことを示した。重要なのは、分子アジュバントとしてCD40Lを含むことで、Th1応答が増強され、ワクチンに関連した免疫病理が防止されたことである63。
ヒト用ワクチンによる増強呼吸器疾患ERDは、免疫群とプラセボ群を統計的に比較するのに十分な感染イベントを伴う、より大規模な第2相および第3相の有効性試験で初めて観察されることになる。COVID-19 ワクチンの安全性プロファイルは、特に免疫病理を引き起こす可能性が理論的に高いと思われるワクチン(不活化ウイルス製剤やウイルスベクターなど)については、ヒトでの有効性試験中にリアルタイムで注意深くモニターする必要がある64,65。
SARS-CoV-2 ワクチンによる 抗体依存性感染促進ADE のリスク
SARS-CoVの動物モデルにおけるワクチン誘発性抗体依存性感染促進ADEの証拠は矛盾しており、潜在的な安全性の懸念をもたらしています。Liuらは、SARS-CoVのSタンパク質を発現させた改良型ワクシニア・アンカラウイルスベクターで免疫したマカクは、チャレンジ後のウイルス複製が減少する一方で、抗S IgGはワクチンを接種していない動物に比べて炎症性マクロファージの肺浸潤を促進し、より重篤な肺傷害を引き起こすことを発見した66。さらに彼らは、ウイルスの除去に先立って抗S IgGが存在すると、マクロファージの創傷治癒反応が炎症促進反応に偏ることを示した。別の研究では、Wangらは、SARS-CoV Sタンパク質の4つのB細胞ペプチドエピトープでマカクを免疫し、3つのペプチドがウイルスチャレンジからマカクを保護する抗体を誘発する一方で、ペプチドワクチンの1つは、in vitroで感染を促進する抗体を誘発し、in vivoではより重篤な肺病理をもたらすことを示した67。
一方,Luoらは,中和抗体の値が低いと生体内での感染が促進されるかどうかを調べるために,中和抗体の値が防御レベルよりも低下した不活化ワクチンによる免疫後9週間目にアカゲザルにSARS-CoVをチャレンジしました68。免疫を受けたマカクのほとんどがウイルスチャレンジ後に感染しましたが、プラセボ対照群に比べてウイルス力価は低く、肺の病理学的レベルも高くありませんでした。同様に、Qinらは不活化SARS-CoVワクチンがカニクイザルをウイルスチャレンジから保護し、中和抗体価の低いカニクイザルでも肺の免疫病理を増強させないことを示した69。ハムスターを用いた研究では、in vitroではFcγRIIを介してB細胞へのウイルス侵入が促進されたにもかかわらず、組換えSARS-CoV Sタンパク質を接種した動物はウイルスチャレンジから保護され、肺の病理学的変化も見られなかった70。
このように、動物モデルを用いたSARS-CoV免疫研究では、採用したワクチン戦略に応じて、防御効果、免疫病理、潜在的な抗体依存性感染促進ADEの点で大きく異なる結果が得られている。にもかかわらず、Sタンパク質に対する中和抗体を誘発するワクチンは、SARS-CoVチャレンジから動物を確実に保護し、感染や疾病の拡大を示す証拠はない71,72,73。これらのデータは、SARS-CoV-2に対するヒトでの免疫戦略は、高い中和抗体価を引き出すことで、抗体依存性感染促進ADEのリスクを最小限に抑えながら成功する可能性が高いことを示唆している。例えば、S特異的な中和抗体を引き起こすことができるサブユニットワクチンは、抗体依存性感染促進ADEのリスクが低いはずである(特に、非中和エピトープの提示を減らすために、プレフュージョン構造で安定化されたSに対して)8。このような最新の免疫原設計アプローチは、非中和抗体に関連する潜在的な免疫病理を軽減するはずである。
病的な抗体依存性感染促進ADEや増強呼吸器疾患ERDを引き起こすリスクが理論的に高いワクチンには、不活化ウイルスワクチンが含まれます。不活化ウイルスワクチンには、中和しない抗原ターゲットや中和しない構造のSタンパク質が含まれている可能性があり、他の呼吸器系病原体で観察されたよく知られたメカニズムを介して追加の炎症を引き起こす可能性のある、多数の非保護的なターゲットが抗体に提供されます。しかし、不活化SARS-CoV-2ワクチンの最近の評価では、マウス、ラット、アカゲザルで強力な中和抗体が産生され、アカゲザルでは病態の悪化を示すことなく、用量依存的な防御効果が得られたことは心強い74。シリアンハムスターはアカゲザルモデルよりもヒトCOVID-19の免疫病理をより忠実に再現していると思われるため、今後、シリア ンハムスターモデルでのワクチン研究を増やすことで、重要な前臨床データが得られる可能性があります75。
抗体依存性感染促進ADEと遺伝子組み換え抗体の介入
SARS-CoV-2のSタンパク質に対するmAbの発見は急速に進んでいる。最近のB細胞スクリーニングと抗体発見の進歩により、回復期のヒトドナー76,77や免疫動物モデル78から強力なSARS-CoV-2中和抗体を迅速に分離することが可能になり、また以前に同定されたSARS-CoV抗体79を再設計することによっても可能になった。今後数週間から数カ月の間に、さらに多くの強力な中和抗体が同定される予定であり、2020年7月にはいくつかのヒト臨床試験が進行中である。ヒトでの臨床試験は、単一のmAbとカクテルの両方について、予防と治療の両方の用途で構成される予定である。また、一部のヒト臨床試験では、抗体依存性感染促進ADEリスクをさらに低減するために、FcRノックアウト変異を取り入れています80。前臨床試験のデータでは、中和の閾値を大幅に上回る用量の強力な中和性mAbであれば、抗体依存性感染促進ADEのリスクは低いことが示唆されており、このmAbは、感染や病気を悪化させることなく、マウスやシリアン・ハムスターをSARS-CoV-2の感染から保護している81,82。mAbの濃度が保護のための閾値を下回って衰えた時期には、抗体依存性感染促進ADEのリスクが高まる可能性がある(これは、デング熱におけるADEの重要な臨床的証拠となった歴史的な母子感染データに類似している83)。この保護濃度以下の範囲は、mAb投与後、初期投与量の大部分が体内から排出される数週間から数ヶ月後に発生すると考えられます。注目すべきは、SARS-CoV-2へのチャレンジに先立ち、RBD特異的な中和mAbを低用量投与したシリア・ハムスターでは、対照動物に比べて体重減少の傾向が見られたことです82が、その差は統計的には有意ではなく、低用量投与の動物は対照動物に比べて肺のウイルス量が少なかったとのことです。また、SARS-CoV-2に対する非中和性mAbをハムスターモデルの感染前または感染後に投与し、非中和性抗体が疾患を促進するかどうかを調べることもできる。また、感染後のさまざまな時点でmAbを受動的に投与することで(例えば、感染のピーク時にウイルス量が多い場合など)、免疫複合体の形成や沈着が疾患や肺の免疫病理の促進につながるかどうかを調べることができる。中和型または非中和型mAbのADEが懸念される場合は、これらの抗体のFc部分にFcR結合を無効にする変異を加えて設計することができます80。動物実験では、マウスのA型およびB型インフルエンザ感染症84,85や、マカクのシミアンHIV感染症86,87に関する過去の研究と同様に、Fcを介したエフェクター機能がSARS-CoV-2感染症の予防、治療、悪化に重要であるかどうかを知ることができる。ヒトmAbを動物モデルで試験する際の重要な注意点は、ヒト抗体のFc領域は、ヒトのFcRと同じようには動物のFcRと相互作用しない可能性があることである88。ADEの前臨床試験に使用する抗体は、可能な限り、Fcエフェクター機能を適切にモデル化するために、種をマッチさせたFc領域を必要とする。
抗体依存性感染促進ADEと回復期血漿による介入
感染者血漿(CP)療法は、有効な抗ウイルス治療薬がない中、多くのウイルス発生時に重症患者の治療に用いられてきた。CP療法は、分子レベルで定義された医薬品が発見され、評価され、大規模に生産されるまでの間、治療のための迅速なソリューションを提供することができる。CP抗体は、理論的には抗体依存性感染促進ADEを介して病気を悪化させる危険性がありますが、SARS-CoVおよびMERS-CoVのアウトブレイクにおける症例報告では、CP療法は安全であり、臨床転帰の改善と関連していることが示されている89,90。SARS発生時に行われた最大規模の研究では、香港で80人のSARS患者を治療したことが報告されている91。プラセボ対照群はなかったが、CPに関連した副作用は検出されず、感染初期に治療を受けた患者の退院率は高かった。重度のCOVID-19患者を対象としたいくつかの小規模な研究や、5,000人のCOVID-19患者を対象とした研究では、CP療法は安全で、疾患の転帰を改善する可能性があることが示されているが、その効果は軽度である97。しかし、これまでのほとんどの研究は非対照で、多くの患者が抗ウイルス剤やコルチコステロイドなどの他の薬剤でも治療を受けていたため、CP療法が回復に寄与したかどうかを判断することは困難である。また、重症のCOVID-19患者はすでにSARS-CoV-2に対する高い抗体価を獲得している可能性があるため、重症患者におけるCP療法の潜在的なメリットも不明である(参考文献47,98)。CPは、基礎的な危険因子を持つ人々、第一線の医療従事者、COVID-19確定症例に接する人々など、高リスク集団への予防的使用が提案されている99。確立された呼吸器感染症と比較して、初期のウイルス感染に関連する抗原負荷が低いことから、予防的使用のためのCPは、治療的使用と比較して、さらに低いADEリスクをもたらす可能性がある。リコンビナントmAbについて前述したように、また、過去のデングウイルスの母子感染のデータに示されているように、CPの予防におけるADEの理論的なリスクは、抗体の血清中和力が保護レベル以下に低下する輸血後の数週間で最も高くなります。CP試験におけるADEリスクは、組換えmAb試験よりも定量化が難しいと思われます。なぜなら、正確なCP組成は、治療を受けた患者や治療プロトコルによって大きく異なり、特に血漿プーリングを行わずに患者とレシピエントの1対1のプロトコルで実施されるCP試験ではその傾向が強いからです。
CPの治療および予防における潜在的な抗体依存性感染促進ADEリスクを軽減するために、血漿ドナーを事前にスクリーニングして、高い中和力を得ることができる。また、抗S抗体または抗RBD抗体を献血されたCPから精製して中和抗体を濃縮し、他のSARS-CoV-2抗原に対する非中和抗体によって引き起こされる抗体依存性感染促進ADEのリスクを回避することもできる。動物モデルを用いた受動的輸液研究は、予防的および治療的使用の両方において、十分に管理された環境でCPのリスクを明らかにするのに役立っている。現在、CPの主要な動物実験(特にシリアン・ハムスターを使用し、抗体のFc領域を一致させたハムスター由来のCPを使用するのが理想的)と、ヒトの臨床における安全性と有効性の結果が同時に発表されている。これらの前臨床および臨床データは、ADEのリスクプロファイルと、輸血関連の急性肺損傷96,100を含む、ヒトのCPで発生しうる他の既知の重篤な有害事象とを比較検討するのに役立つと考えられる。
結論
抗体依存性感染促進ADEは、SARS、MERS、およびRSVや麻疹を含む他のヒト呼吸器ウイルス感染症で観察されており、SARS-CoV-2ワクチンや抗体ベースの介入にADEの現実的なリスクがあることを示唆している。しかし、臨床データは、ヒトCOVID-19の病理におけるADEの役割をまだ完全には確立していない。免疫療法によるADEのリスクを低減するためには、ADEを引き起こす可能性の高い低濃度の非中和抗体ではなく、高用量の強力な中和抗体を誘導または投与することが必要です。
今後は、動物および臨床データを用いて抗体依存性感染促進ADEの兆候を評価し、臨床的にADEが認められた場合には、抗体依存性感染促進ADEに関連する安全性リスクと介入効果のバランスをとることが重要となる。現在進行中の動物実験およびヒトの臨床研究は、COVID-19における抗体依存性感染促進ADEのメカニズムについて重要な洞察を与えてくれると期待される。このような証拠は、COVID-19の世界的な負担を軽減するために必要となるであろう大規模な医療介入において、製品の安全性を確保するために切実に必要とされている。
まとめ
中和抗体が少ないと、かえってマクロファージに新型コロナウイルスを運び、自然免疫を担当する食細胞がウイルスを増殖させることにつながり、大事な一次防衛戦線が破綻する可能性がある、というのは確かに理論的には十分考えられます。
問題は、中和抗体が少ない、多いをどこで見極めるか、ということなのかなと感じました。
あとはワクチンそのものの有害事象を個体ごとに予測できるような検査方法が確立し、ワクチンを受けたほうが良い人と受けないほうが良い人の見極めが可能となれば素晴らしいですね。





コメント