www.nature.com/articles/s41591-020-0897-1
今回は,こちらの論文をご紹介したいと思います.
SARS-CoV-2に対する急性抗体反応
抄録
我々はCOVID-19患者285例におけるSARS-CoV-2に対する急性抗体反応を報告する.症状発現後19日以内に,100%の患者が抗ウイルス免疫グロブリン‐G(IgG)陽性を示した.IgGとIgMのセロコンバージョン(訳者注:抗原が検出されなくなり抗体が検出されること)は同時にまたは連続的に起こった.IgGとIgMの力価はセロコンバージョン後6日以内にプラトーに達した.血清学的検査は,RT-PCR結果が陰性の疑わしい患者の診断および無症候性感染の同定に有用であると考えられる.
本文
2019年のコロナウイルス病(COVID-19)の拡大が続いたことで世界中で懸念が広がり,2020年3月11日,世界保健機関(WHO)はCOVID-19のパンデミックを宣言した.重症急性呼吸器症候群(SARS)及び中東呼吸器症候群(MERS)に関する研究では,発症1,2,3,4,5,6投与後2週目に80~100%の症例でウイルス特異抗体が検出可能であることが示された.現在,SARS-CoV-2に対する抗体反応は依然としてほとんど解明されておらず,血清学的検査の臨床的有用性は不明である7.
COVID-19患者計285例を指定された3つの病院から本研究に登録した;これらの患者のうち,70例は連続的なサンプルが利用可能であった.これらの患者の特徴を補足表1および2に要約する.ウイルス特異的抗体検出のための磁気化学発光酵素免疫測定法(MCLIA)を検証し,使用した(拡張データ図1a-dおよび補足表3).
拡張データ図1
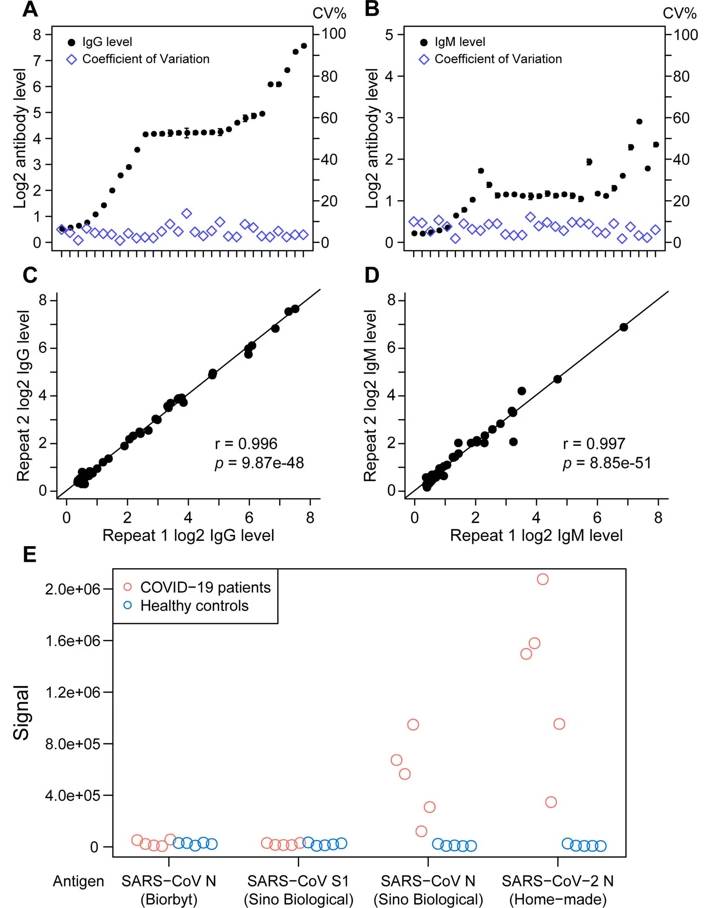
COVID-19患者の血清サンプルは,SARS-CoVスパイク抗原のS1サブユニットとの交差結合を示さなかった.しかし,我々は,COVID-19患者の血清サンプルがSARS-CoVのヌクレオカプシド抗原に対して若干の交差反応性を観察した(拡大データ図1e).ウイルス特異的IgG陽性患者の割合は,症状発現から約17~19日後に100%に達したが,ウイルス特異的IgM陽性患者の割合は,症状発現から約20~22日後に94.1%のピークに達した(図1aおよび方法).症状発現後最初の3週間は,ウイルス特異的IgGおよびIgM抗体価の上昇が認められた(図1b).しかし,IgMは≦3週群と比較して>3週群でわずかな減少を示した(図1b).重症群のIgGおよびIgM価は非重症群より高かったが,有意差が認められたのは症状発現後2週群のIgG価のみであった(図1c,P = 0.001).
図1:SARS-CoV-2に対する抗体反応.
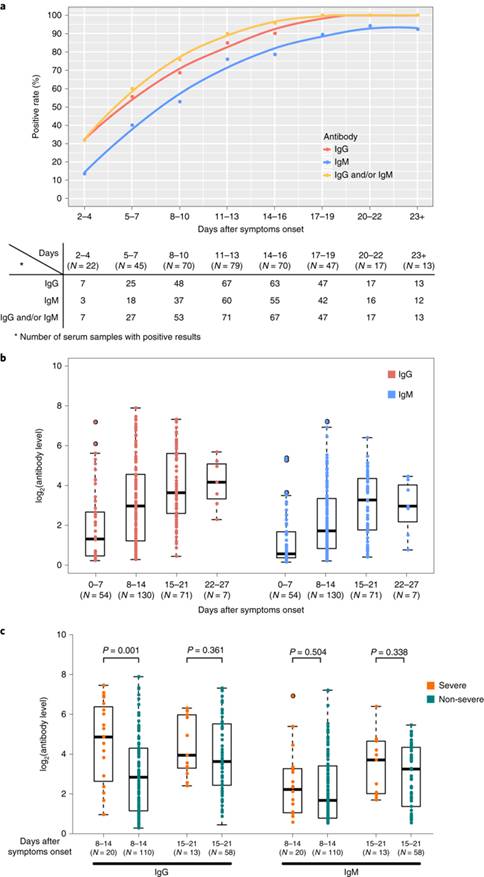
a, 患者262例の血清363検体におけるウイルス特異的IgGおよびIgMの陽性率対症状発現後日数のグラフ.
b, 症状発現後の異なる時期の患者におけるSARS-CoV-2に対する抗体のレベル
c, 重症患者と非重症患者のSARS-CoV-2に対する抗体レベルの比較
bおよびcのボックスプロットは,中央値(中央線)ならびに第3および第1の四分位(ボックス)を示し,ウィスカーは,ボックスの上下の四分位間範囲(IQR)の1.5倍を示す.患者数(N)を下に示す.P値は対応のない両側Mann-WhitneyのU検定で決定した.
COVID-19が確認された63例を退院まで血清サンプルを3日間隔で採取して追跡した..このうち,全セロコンバージョン率は追跡期間で96.8%(61/63)であった.母娘の2例は入院中IgG,IgM陰性状態を維持していた.最初に血清陰性であり,その後観察期間中にセロコンバージョンを受けた26例について血清学的経過を追跡することができた.これらの患者は全て,症状発現後20日以内にIgGまたはIgMのセロコンバージョンを達成した.IgGとIgMの両方のセロコンバージョンの中央日は,症状発症後13日であった.セロコンバージョンは,IgGとIgMの同時セロコンバージョン(9例),IgGより早期のIgMセロコンバージョン(7例),IgGより遅いIgMセロコンバージョン(10例)の3種類が観察された(図2a).3種類のセロコンバージョンの代表的な患者6例における抗体の縦断的変化を図2b-dおよび拡張データ図2a-cに示す.
図2:SARS-CoV-2に対する抗体のセロコンバージョン時間.
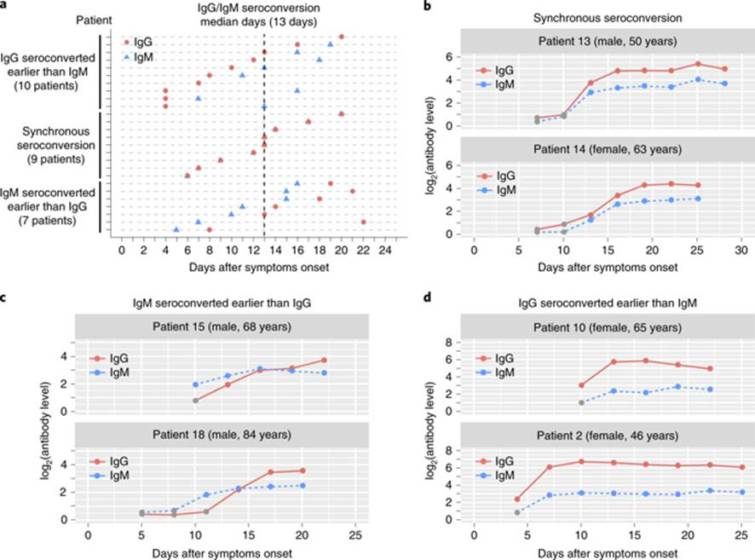
a, 観察期間中に当初血清陰性であった26例のセロコンバージョン型.各患者のセロコンバージョン日数をプロットする.b-d,3種のセロコンバージョン型の代表例6例:IgGとIgM (b)の同時セロコンバージョン,IgG (c)より早期のIgMセロコンバージョン,IgG (c)より遅いIgMセロコンバージョン.
入院中にIgGセロコンバージョンを行った19例のIgG値は,最初のIgG測定陽性から6日後にプラトーに達した(拡大データ図3).
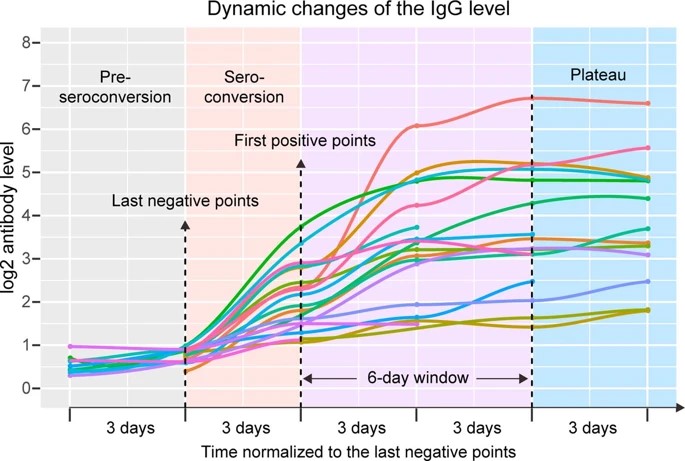
血漿IgG濃度は患者間で大きく異なっていた(20倍以上).IgMも同様の動的変化のプロファイルを示した(拡張データ図4).
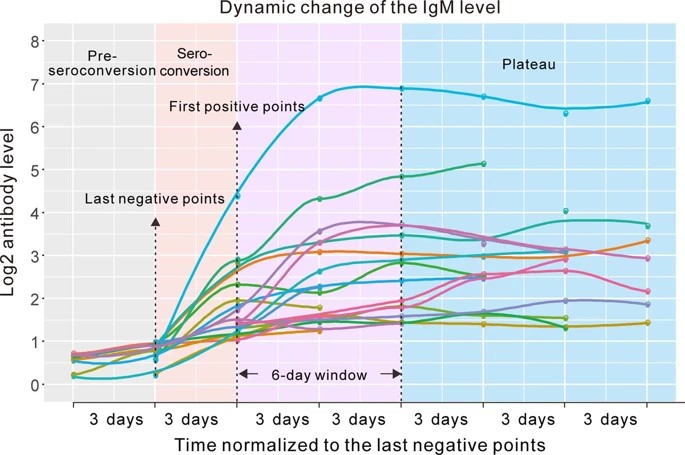
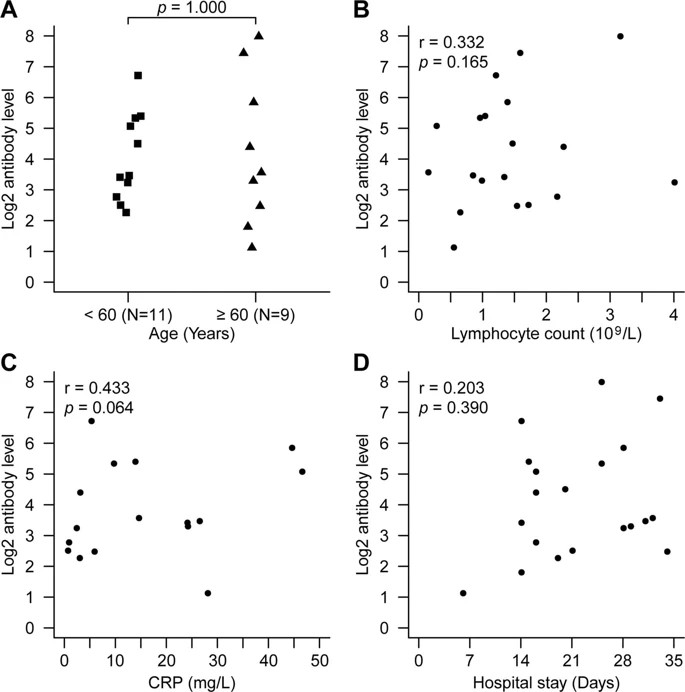
プラトーIgG値と患者の臨床的特徴との間に関連性は認められなかった(拡大データ図5a-d).
次に,(1)セロコンバージョンまたは(2)IgG特異的抗体価の4倍増加を含むWHOが推奨するMERS-CoV感染の確認のための基準が,COVID-19の診断に適しているかどうかを分析した(41人の患者のペアサンプルを使用).最初のサンプルは病気の最初の週に採取し,2回目は2~3週間後に採取した.IgGが疾患の最初の1週間で最初に血清陰性であった患者のうち,51.2%(21/41)がセロコンバージョンを受けた.計18例が最初の1週間で血清陽性を示し,そのうち8例でウイルス特異的IgG価が4倍上昇した(拡大データ図6).
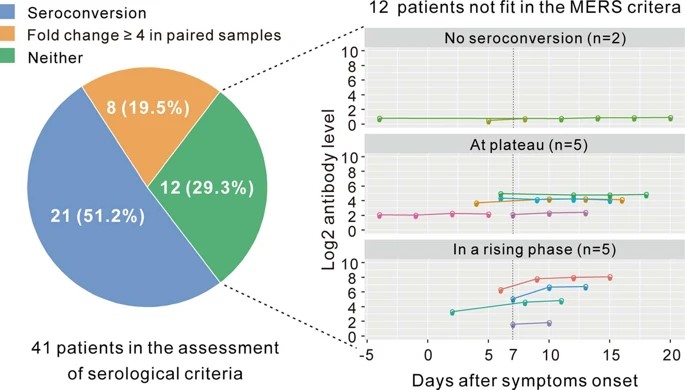
全体で,COVID-19患者の70.7%(29/41)がIgGセロコンバージョンの基準を満たし,かつ/またはIgG力価が4倍以上上昇した.
血清学的検査がCOVID-19患者の同定に役立つかどうかを検討するために,COVID-19の症状または異常な放射線学的所見を示し,少なくとも2つの連続したサンプルでウイルスRNAの検査が陰性であった患者において,疑わしい52症例をスクリーニングした.疑い例52例のうち,4例は初回検体でウイルス特異的IgGまたはIgMを有していた(拡大データ図7).

患者3は,最初の血清学的検査の3日後にIgG力価が4倍以上上昇した.興味深いことに,患者3はまた,2つの抗体測定間で逆転写(RT‐PCR)を伴うポリメラーゼ連鎖反応によりウイルス感染について陽性であった.IgM力価は,患者1からの3つの連続サンプルで増加した(<4倍).患者4は,2つの連続したサンプルにおけるカットオフ値よりも100倍高いIgGおよび10倍高いIgM力価を有した.患者2はウイルス特異的IgGとIgMの両方に陽性であった.連続サンプルにおけるIgGおよび/またはIgMの増加,または症状の2週間後に採取した単一サンプルにおける陽性結果は,これらの3人の患者がSARS-CoV-2に感染したことを示唆している.
著者らはさらに,既知のCOVID-19患者の密接な接触者164例のクラスターにおいて,サーベイランスにおける血清学的検査の適用を実証した.16名がRT-PCR法によりSARS-CoV-2に感染していることが確認され,3例は症状を報告しなかった.残りの148名はRT-PCRの結果が陰性で,症状は認められなかった(拡張データ図8).

これら164名から血清サンプルを採取し,曝露後約30日に抗体検査を行った.RT-PCRで確認された16例は,すべてウイルス特異的IgGおよび/またはIgM陽性であった.さらに,RT-PCRの結果が陰性であった148人のうち7人はウイルス特異的IgGおよび/またはIgMが陽性であったことから,濃厚接触者の4.3%(7/164)が核酸検査で見逃されていたことが示された.ウイルス特異的IgGおよび/またはIgMが陽性であった164人の濃厚接触者のうち10人は無症候性であった.
著者らの研究は,MERS-CoV感染の確認のための基準が,COVID-19のほとんどの患者に適していることを示した.しかし,12.2%(5/41)の患者が症状発現から7日以内にIgG力価がすでにプラトーに達していたため,一部の患者がこれらの基準を満たすためには,可能な限り早期に最初の血清サンプルを採取する必要がある(拡大データ図6).理想的なウインドウの間にサンプリングされなかった患者については,SARS-CoV-2感染に対する抗体反応を確認するために,繰り返し血清学的検査が必要であろう.
我々の研究にはいくつかの限界がある.第一に,我々はウイルス中和についてサンプルを検査しなかったため,検出されたIgG抗体の中和活性は不明である.第二に,重症・危篤状態にある患者の症例数が少ないため,抗体反応と臨床経過との関連を明らかにすることは困難である.
RT-PCRに基づくウイルスRNA検出は感度が高く,早期のSARS-CoV2感染を効果的に確認できる8.我々のデータは,COVID-19に対するウイルス特異的抗体検出が,(1)RT-PCRの結果が陰性である疑わしい症例の診断のための核酸検査の補完として,および(2)密接な接触者における無症候性感染の調査において重要であることを示している.血清学的検査の助けにより可能な限り早期にCOVID-19が疑われる症例を確認することで,反復サンプリング中の暴露リスクを低下させ,貴重なRT-PCR検査を節約することが可能である.われわれの小規模調査では,核酸結果が陰性で症状のない7例がIgGおよび/またはIgM陽性を示した.このことは,COVID-19パンデミックの程度のより正確な推定を達成するための血清学的検査の重要性を浮き彫りにしている.
方法
研究デザイン
COVID-19流行の出発点であり,流行の中心であった湖北省に隣接する地方レベルの自治体である重慶の指定病院3施設から,COVID-19患者計285例を本横断研究に登録した.これら3つの病院-重功三角中央病院(TGH),重功医科大学付属の青中病院(CQMU) (YCH)および重功公衆衛生医療センター(CQPHMC)-は,3つの指定地域から患者を入院させるために重功市民政府によって割り当てられた.登録された全患者は,鼻腔および咽頭スワブ検体でRT-PCR法によりSARS-CoV-2に感染していることが確認された.これらの登録患者の年齢中央値は47歳(IQR,34~56歳)であり,55.4%は男性であった.そのうち250例に疫学的既往があったが,262例に症状発現の明確な記録があり,70例に複数の血清検体があった.明らかな症状発現歴のある患者から採取した計363点の血清サンプルを分析対象とした.285人の患者のうち,39人は,National Health Commission & State Administration of Traditional Chinese Medicineが発表した,Diagnosis and Treatment Protocol for Novel Coronavirus Pneumonia (Trial Version 7)追跡コホートについては,YCH患者63例の血清サンプルを2020年2月8日から退院まで3日間隔で採取した.WHOが推奨するMERS-CoV確認のための血清学的基準がCOVID-19の診断に適しているかどうかを分析するために,以下の2つの選択基準を患者をスクリーニングするために設定した:(1)発症の最初の週以内に採取された最初の血清サンプル,または(2)発症から少なくとも7日以内に採取されたがIgG陰性の最初の血清サンプル.34例が基準1を満たし,7例が基準2を満たした.
COVID-19診断における血清学的検査の可能性を評価するために,我々は,呼吸器症状または肺画像検査の異常を有するが,少なくとも2回の連続検査でRT-PCR結果が陰性であった,和州人民病院(中国重陽)に入院したCOVID-19が疑われる52人の患者を登録した.拡大データ図7に示す時点で血清サンプルを採取し,SARS-CoV-2に対する抗体を検査した.
164人からなる密接な接触者のクラスターで血清学的調査を実施し,地域の疾病管理・予防センター(和州,重慶)が同定した.武漢市から帰国し,2020年2月4日にSARS-CoV-2感染が確認された夫婦は,この連絡網の第1世代の患者とみなされた.このコホートの他の症例はすべて,2020年1月20日から2月6日までの期間にこのカップルと密接な接触(直接的または間接的に)があった.3月1日,これら164例から血清サンプルを採取し,抗体検査を行った.
定義
疫学的既往歴のある患者は,武漢研修医,近年武漢(発症30日前),確認症例と接した地域住民と定義した.セロコンバージョンは,SARS-CoV-2に対するIgGまたはIgMの検査結果が,連続したサンプルで陰性から陽性の結果に移行したものと定義した.測定した化学ルミネセンス値をカットオフ値(吸光度/カットオフ値,S/CO)で除した値として抗体値を提示した: S/CO >1を陽性,S/CO≦1を陰性と定義した.
SARS-CoV-2に対するIgGおよびIgMの検出
SARS-CoV-2に対するIgGおよびIgMのレベルを測定するために,患者から血清サンプルを採取した.すべての血清サンプルを56℃で30分間不活化し,試験前に-20℃で保存した.血漿サンプル中のSARS-CoV-2に対するIgGおよびIgMを,バイオサイエンス社から供給されたMCLIAキット(中国国家医療製品局の承認;承認番号20203400183(IgG)および20203400182(IgM))を用い,製造者の指示に従って検査した.IgGまたはIgM検出のためのMCLIAを,二重抗体サンドイッチ免疫アッセイに基づいて開発した.核タンパクとSARS‐CoV‐2のスパイクタンパク由来のペプチドを含む組換え抗原をFITCと結合させ,抗FITC抗体結合磁性粒子上に固定化した.検出抗体はアルカリホスファターゼ結合抗ヒトIgG/IgM抗体を用いた.自動磁気化学発光分析装置(Axceed 260, Bioscience社)で製造者の指示に従って試験を行った.すべての試験は厳格なバイオセーフティ条件下で実施された.抗体価は血清検体につき1回検査した.抗体レベルは,測定された化学ルミネセンス値をカットオフ値(S/CO)で除したものとして提示する.この試験のカットオフ値は受信者動作特性曲線により定義した.図中のアンチボディレベルは,対数2(S/CO + 1)として算出した.
SARS-CoV-2特異的IgG/IgM検出アッセイの性能評価
MCLIAキットの精度および再現性は,国立食品医薬品管理研究所によって最初に評価された.さらに,異なる力価のIgG (範囲0.43~187.82)およびIgM (範囲0.26~24.02)を示すCOVID‐19患者由来の30の血清サンプルを試験した.各個々のサンプルを3つの独立した実験で試験し,変動係数(CV)を用いてアッセイの精度を評価した.最後に,COVID-19患者の46点の血清サンプルを,SARS-CoV-2特異的IgGまたはIgM抗体の診断キットの異なるバッチを用いて評価した;再現性は,2つのバッチ実験の結果に基づいて算出した.
SARS-CoVおよびSARS-CoV-2由来の抗原の交差反応性
2つの異なる供給源(Sino Biological,ネコ番号40143-V08B; Biorbyt,ネコ番号orb82478),SARS-CoVスパイクの組換えS1サブユニット(Sino Biological,ネコ番号40150-V08B1)およびSARS-CoV-2の自家製組換えNタンパクからの2つの組換えSARS-CoVヌクレオカプシド(N)タンパクを,それぞれ化学発光酵素免疫測定法(CLEIA)で用いた.平板塗布に用いた抗原は0.5μg ml −1であった.アルカリホスファターゼ結合ヤギ抗ヒトIgG抗体の希釈は1:2,500であった.COVID-19患者の血清5検体および健常対照者の血清5検体を希釈(1:50)し,CLEIAアッセイを用いて検査した.試料中の抗原に対する抗体の結合能を相対的ルミネセンス単位で測定した.
統計解析
連続変数は中央値(IQR)で表し,Mann-WhitneyのU検定と比較した.カテゴリー変数は数字(%)で表し,フィッシャーの直接確率検定により比較した.P値<0.05を統計学的に有意とみなした.統計解析はRソフトウェア,version 3.6.0を用いて行った.


コメント