ウイルスの病原性って何が決めるの?
わたしは 感染症専門医 ではありません。
普通の 総合内科専門医 です。しかし。今と違って私たちが取得したころの内科専門医というのは、各サブスペシャルティ専門医(がん薬物療法専門医とか循環器専門医とか感染症専門医とか)を総合的に束ねる専門医ということで、認定医⇒サブスぺ専門医⇒内科専門医、という位置づけだったんですよね。内科学会では。
今は総合内科専門医は3万人以上いますが、わたしの専門医番号は7900です。
古き良き厳しかった時代の内科専門医として、意地になってお勉強しております!!
なので、皆さんも私と一緒にお勉強して、正しい知識をもって、落ち着いて過ごせるようになりましょう。
ウイルスの毒性を主に決定する因子
1.ウイルスの増殖力
2.ウイルスの臓器親和性
顕性感染と不顕性感染
感染して明らかな症状がでるのを顕性感染。出ないのを不顕性感染と言います。
ウイルスが宿主に感染すると必ず病気になるわけではありません。むしろ、ウイルスに感染しても病気として気づかれることなく終わってしまう場合が多いのです。
このような感染を不顕性感染または無症候性感染といい、一見健康な人間がウイルスを排泄する感染源の役割をになっているという意味で、疫学上の意義が大きくなります。
したがって、感染の結果、病気になる割合がどの程度あるかということを把握することは大切です。
主なウイルス感染症における顕性感染の頻度はこのようになっています。
| ウイルス | 年齢 | 顕性感染の頻度 |
|---|---|---|
| ポリオ | 小児 | 0.1~1% |
| 成人 | ~10% | |
| 日本脳炎 | 0.1~4% | |
| A型肝炎 | 乳幼児 | ~5% |
| 学童 | 10~15% | |
| 成人 | 35~50% | |
| B型肝炎 | 小児 | 1~数% |
| 成人 | 30~40% | |
| EBウイルス | 乳幼児 | 1% |
| 学童 | ~10% | |
| 青年 | 35~50% | |
| ロタウイルス | 乳幼児 | 1% |
| 新生児・成人 | ~10% | |
| アデノウイルス | 50% | |
| 流行性嘔吐下痢症 | 50% | |
| 風疹 | 50% | |
| インフルエンザ | 50~60% | |
| ライノウイルス | 80% | |
| 流行性耳下腺炎 | 70% | |
| 水痘 | 95~99% | |
| 麻疹 | 95~99% | |
| 狂犬病 | 100% | |
| HIV | 100% |
ウイルスの病原性
ウイルス感染の帰結が病気になるのか、あるいは不顕性感染にとどまるのかということは、何によって規定されているのでしょうか?
概念的にいえば、感染するウイルスの毒力と宿主のそのウイルスに対する感受性によって決まります。
ウイルスの病原性とは、ウイルスが宿主との相互作用を介して病気を起こす能力のことで、ウイルスの直接的細胞障害作用のみによるものではなく、宿主とのかかわりあいを包括して考えないといけません。
例えば、B型肝炎ウイルスHBVは肝炎を起こしますが、実は、HBVそれ自身の肝細胞に対する直接的障害作用はほとんどといってありません。HBV感染の結果肝炎になるのは、宿主の免疫機構がHBVに感染している肝細胞を排除しよう(殺そう)とする免疫応答の結果によるものなのです。
宿主とウイルスの相互作用の帰結としてのウイルスの病原性は、
細胞のレベル
個体のレベル
集団のレベル
に大別されます。
細胞レベルでのウイルスの病原性
ウイルスの毒力とは、同じウイルスの仲間同士の間で、病気を起こす能力の相対的程度を表す言葉です。
ロタウイルスとポリオウイルスで考えてみましょう。
ロタウイルスは様々な動物に下痢を起こしますが、マウスに下痢を起こさせるのに必要なサルロタウイルスの量は、マウスのロタウイルスのおよそ10万倍です。つまり、マウスのロタウイルスはマウスに対してサルロタウイルスより、10万倍も毒力が強いのです。
ポリオウイルスの野生株をサルの脳内に接種すれば麻庫を起こすが、生ワクチン株を同じく接種しても麻痺は起こさしません。これは野生株と生ワクチン株との毒力の違いによるものです。
野生株感染によるポリオの発症は1、000人あたり1~10人である野に対して、生ワクチン株投与による麻原の発症はおよそ100万人あたり1人であるから、生ワクチン株は野生株に比べて、毒力が1/1000-1万に弱められています。
ウイルスの毒力の決定因子とは何でしょうか?
何がこのようなウイルスの株による毒力の違いを決めているのかを考えましょう。
ロタウイルス感染の結果下痢になるという背景には、小腸での水分吸収の機能が失われるほど多くの腸上皮細胞が感染をうけるという現象が必要です。少量のウイルスを投与しても下痢を起こすのは、投与された少量のウイルスが小腸でたくさん増殖した結果、多くの腸上皮細胞に感染したということを意味します。
つまり、マウスに下痢を起こさせるのに、どれだけの量のウイルスを投与すればよいのかは、そのウイルス株がマウスの消化管でどれだけよく増殖するかということによって決まるのです。
このことから、ウイルスの毒力の決定因子の1つはウイルスの増殖力であるといえます。
増殖力ということについていえば、ポリオウイルスの野生株(強毒株)も生ワクチン株(弱毒株)の間で変わりはないのです。それではなぜ、生ワクチンのほうが弱毒なのでしょうか?答えは、中枢神経細胞への親和性にあります。生ワクチンのほうが中枢神経への親和性が低いのです。したがって特定の臓器への親和性もウイルスの毒力の決定因子の1つであるということになります。
個体レベルでのウイルスの病原性
ウイルス感染の体内での広がり方、つまり個体レベルでのウイルス感染には、秩序だった一連の段階があります。
宿主への侵入
1)侵入門戸と排泄部位
宿主へ感染するためにウイルスが使うさまざまな侵入門戸があります。
軌道粘膜
眼球結膜
皮膚
泌尿生殖器
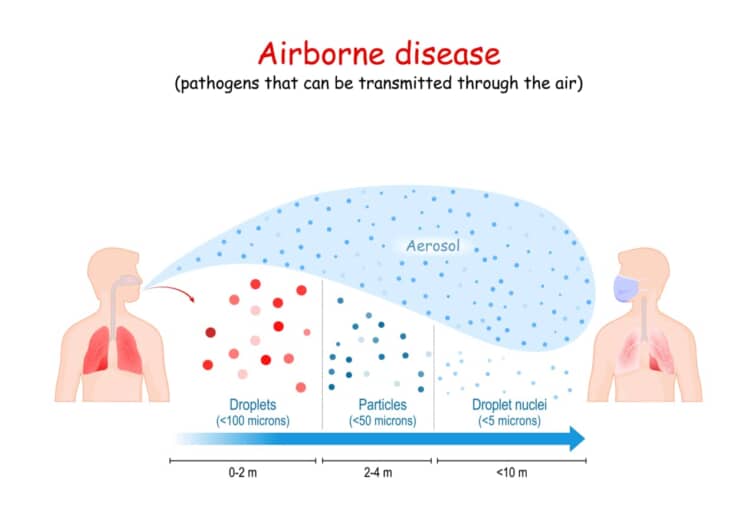
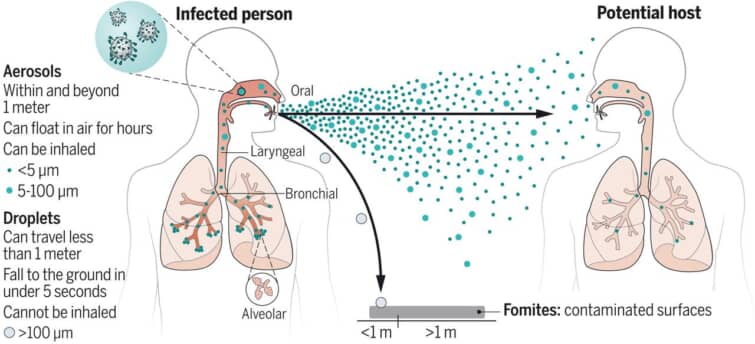
このうち最も多くのウイルスが侵入に際してとるルートが消化管(糞口感染)と呼吸器(気道感染)です。
また、これらの部位は増殖したウイルスが新たな宿主を求めて出ていく主要な経路でもあります。
消化管や呼吸器の微小環境は感染を企てるウイルスにとって厳しいもので、現実には数多くの病原体が感染に至らずに終わっています。
これから消化管と呼吸器について、感染に成功するウイルスがどのような特徴をもっているのかをみていきましょう。
消化管
ウイルスが遭遇する消化管の微小環境には、パイエル板と呼ばれるリンパ組織が豊富にあります。腸管は実は人体のリンパ組織の1/3を擁する最大の免疫応答組織なのです。
腸にたどり着くまでにも関門があります。
同じピコルナウイルス科のウイルスでありながら、エンテロウイルスは胃酸のpHに耐えるが、ライノウイルスは不活化されてしまい、小腸にたどり着けません。
肝臓は胆汁を作っていますが、これに含まれる胆汁酸には界面活性剤の作用があり、多くのウイルスのエンベロープ(細胞の膜に由来し、脂質からなる2重膜でできている)をもつウイルスにとって大敵となっています。
A型肝炎ウイルスHAVもHBVもともに肝臓で増殖し、胆汁中に排泄されながら、HBVはエンベロープをもつためにその感染力を失います。HAVはエンベロープをもたないために胆汁酸の影響をうけることなく、感染性をもった粒子が糞便から排泄されます。
膵臓から分泌されるさまざまの消化酵素も本来ウイルスにとって大敵なのです、ロタウイルスのように、プロテアーゼでウイルスタンパクの一部が消化切断されることによって、逆に感染性を獲得するウイルスもあります。
呼吸器
ウイルスが遭遇する呼吸器の微小環境には、粘液の層と、線毛をもつ細胞の線毛運動があります。ウイルスは線毛にくっつき、粘液にまるめこまれ、線毛運動で咽頭までほうきで掃くような感じで押し返され、消化管に落ち込むことになります。これを免れたウイルスのみが侵入できるのです。
線毛への強固な吸着は、一般に糖タンパクのスパイクをもつ、エンベロープをもつウイルスの方が有利となっています。インフルエンザウイルスもコロナウイルスもエンベロープを持ちます。
初期増殖
宿主に侵入したウイルスは、その侵入門戸の近傍の組織に初期増殖の場を作ります。
ロタウイルスは口から侵入し、小腸上部で、絨毛の先端近くの機能的に分化した粘膜上皮細胞で初期増殖を開始します。ウイルスは基底膜を越えて粘膜固有層に侵入することなく、水平方向へ感染を拡大しつつ、消化管腔にウイルスを排泄し、次の宿主への感染源となります。広範な小腸粘膜上皮細胞の障害により、小腸の水分吸収能力が阻害され、その結果として下痢を起こします。
これに対して、ポリオウイルスは口から侵入した後、咽頭や小腸の粘膜下のリンパ組織で初期増殖をします。ポリオウイルスの感染は、ウイルスがM細胞という特殊な粘膜上皮細胞から侵入し、その直下にあるパイエル板などのリンパ組織で増殖することから始まり、増殖し、消化管腔に排泄された後、次の宿主を求めて伝播していきます。
体内伝播
局所感染と全身感染
局所感染とは、侵入したウイルスが初期増殖の場から、近傍の組織へと直接的に広がっていく感染の様式で、感染が体腔の表面に留まることが多いので表面感染とも呼ばれます。
全身感染とは、侵入門戸の近傍で初期増殖したウイルスが、リンパ管や血管あるいは神経に沿って、全身の標的臓器に広がり、二次増殖し、臓器障害を起こすという感染の様式です。
典型的な局所感染であるライノウイルス感染による普通感冒やロタウイルスによる下痢症では、ウイルスの感染が侵入門戸の近傍の粘膜表面から急速に広がり、3~4日でウイルスの増殖がピークに達するが、インターフェロンやNK細胞などの、初期防御機構の働きにより1週間程度で感染は終結します。
ウイルスの伝播という観点からみると、大量のウイルスを短期間排泄することにより、自然界で生き延びていくというウイルスの生き残り戦略です。
全身感染として麻疹ウイルスをみると、侵入門戸である咽頭のリンパ組織ではごくわずかに増殖する程度で、感染はリンパ・血行性に全身に広がり、ウイルスの増殖が標的臓器でピークに達するまでに10日程度かかります。感染からの回復には細胞傷害性T細胞を中心とした免疫が働きます。
それでは、局所感染と全身感染を規定しているのは何なのでしょうか?
あるウイルスが局所感染に留まるのか全身感染へと進展していくのかを規定しているのは何なのでしょうか。
その1つにマクロファージという細胞での増殖の可否があげられます。すなわち、多くの全身感染型の感染様式をとるウイルスが侵入門戸近傍のリンパ組織中のマクロファージを初期増殖の場として利用しています。一方、局所感染型のウイルスはマクロファージで増殖できないものが多い。
また、インフルエンザウイルスのHAタンパクに代表されるエンベロープの膜融合タンパクが、組織に存在するプロテアーゼ(タンパクを切断する酵素)により消化切断されるかどうかということも局所感染と全身感染を規定している因子の1つとなっています。
インフルエンザウイルスの場合、気管上皮から分泌されるトリプシン様酵素によって切断される部位が1、2個所しかなく、呼吸器に限局した感染に留まります。
一方、全身感染を起こす麻疹ウイルスでは、酵素による切断部位が多数存在しています。
ウイルスの体内伝播様式
全身感染を起こすウイルスが初期増殖の場から遠隔の標的臓器に到着する主要な経路には
a)リンパ・血行性
b)純粋な血行性
c)神経行性
があります。
最も多いのが、初期増殖の場から、所属リンパ節、胸管を経て大循環に入り、最終的な標的臓器に到達するリンパ・血行性伝播です。
播純粋な血行性伝播も頻度は少ないながら存在します。アルポウイルスを保有する節足動物による刺咬、ウイルスが傷口から血管内に直接侵入する場合、さらにウイルスで汚染された血液の輸血や血液製剤を介する伝播などがこれにあたります。
狂犬病ウイルス、単純へルペスウイルス、水痘・帯状庖疹ウイルスvaなど、神経の軸索に沿って伝播していくウイルスでは神経行性伝播の形式をとります。神経行性伝播neuralspreadの経路には免疫学的防御機構がほとんど働きません。
ウイルスの臓器親和性
ウイルスがある特定の臓器や組織に感染する性質のことを臓器親和性と言います。。例えば、日本脳炎ウイルス、狂犬病ウイルス、ポリオウイルスなどは、いずれも中枢神経系の組織でよく増殖し、そこで障害を起こします。これらのウイルスは分類上は、全く異なった種類のウイルスですが、この共通の臓器親和性のゆえに、向(好)神経性ウイルスneurotropicvirusと呼ばれることがある。
侵入門戸
それぞれのウイルスには、決まった侵入門戸があり、その近傍に増殖のホームベースを築こうとして宿主の防御機構と戦います。
ウイルスレセプター
細胞レベルでのウイルスの感染は、ウイルス粒子が細胞表面のウイルスレセプターに吸着することから始まります。したがって、ある臓器や組織に存在する細胞にこのウイルスレセプターがあるかどうかがその臓器や組織でウイルスが増殖できるかどうかの因子の1つになることは容易に理解できます。
SARS-cov-2は、ACE2というリセプターを介して細胞に感染します。
組織特異的細胞因子
細胞レベルでのウイルス感染は、確かにウイルス粒子が細胞のレセプターに吸着することから始まるが、いったん吸着すればその後のプロセスが、問題なく進行するとはかぎりません。
細胞内で、ウイルスの遺伝子発現が起こり、ウイルスタンパクが合成される一方、ウイルスのゲノムの複製が進み、新たな子孫ウイルス粒子が形成されるまでには、さまざまな組織特異的細胞因子との相互作用が必要となります。ウイルスが細胞をウイルスの生産工場に変えることができなければ、有効な感染には結びつかないのです。
したがって、転写調節因子をはじめとするさまざまな組織特異的細胞因子は、ウイルスの臓器親和性を規定している因子の1つになっている。
たとえば、ヒトパピローマウイルス11型は生殖器の皮膚粘膜に感染して尖形コンジローマの原因となるのですが、このHPV-11が示す組織親和性、つまり特定の角質細胞でのみ増殖するのは、このウイルスのエンハンサー(遺伝子発現を促進する因子)が角質細胞でのみ活性化されるために、この細胞でのみウイルスの遺伝子発現が起こるからです。このようにパピローマウイルスの組織親和性には、組織特異的細胞因子とウイルスのエンハンサーとの相互作用が重要な役割をにはたしています。
プロテアーゼ依存性臓器親和性
プロテアーゼ(タンパク分解酵素)は一部ウイルスの臓器親和性を規定しています。
ウイルスによる細胞損傷の機序
1.タンパク合成のシャットオフ
ウイルスが感染細胞での宿主のタンパク合成を感染の早期に急激に止めることがあります。宿主タンパク合成のシャットオフshutoffと呼んでいます。多くのウイルス感染でこのシャットオフが起こり、またタンパク合成のシャットオフの結果、細胞が崩壊することが多いのです。
2.アポトーシスの誘導
ウイルス感染の結果、感染細胞にアポトーシス(一定のプログラムに従って細胞死に陥ること)が誘導されることがあります。これはウイルスによる細胞障害作用ともいえますが、ウイルス感染細胞を死に追い込むことにより排除しようという生体防御機構の発動でもあります。
アデノウイルスや単純へルペスウイルスには宿主細胞のアポトーシスを抑制する遺伝子があり、これが持続感染の成立に関与しています。
HIV感染によるエイズ発症の基本的病態は、CD4陽性Tリンパ球の枯渇による免疫不全なのですが、Tリンパ球が枯渇するメカニズムは、HIVによる感染細胞の破壊のみでは説明できず、非感染細胞にもアポトーシスが誘導されることがその一因になっています。
3.ウイルスタンパクの毒素様作用
細菌には毒素がいろいろ報告されていますが、ウイルスでは少数派で、アデノウイルスのキャプシドタンパクであるペントンとロタウイルスの非構造タンパクであるNSP4のみとなっています。
精製したアデノウイルスのペントンを培養細胞に加えると、すぐに細胞が死にはじめます。これは、ペントンの細胞に対する毒素様作用のためと解されているが、その詳細なメカニズムはよくわかっていません。
ロタウイルスのNSP4は、分子シャペロンとしてウイルスの形態形成に関与する感染細胞の小胞体膜に局在する非構造タンパクです。このような働きに加えて、NSP4は非感染細胞のNSP4レセプターに吸着することにより、シグナル伝達を介して、小胞体に貯蔵されているカルシウムイオンを細胞質に放出させます。この結果、クロールイオンが細胞外に失われ、水分の吸収が阻害されてしまうのです。このようにして、ロタウイルスは下痢を起こすのではないかと考えられています。
4.性酸素と一酸化窒素(NO)
ウイルス感染細胞で活’性酸素や一酸化窒素NOが産生されると、これらの強い細胞障害作用により、細胞を損傷します。活性酸素がインフルエンザウイルス感染に際しての組織障害に関与していることが示されています。
5.ウイロカイン
ウイロカインvirokineとは、ウイルス遺伝子の直接産物で、生体の初期防御や免疫機構に干渉してウイルスの病原性発現に関与するものをいいます。
したがってウイロカインは、ウイルスの培養細胞での増殖には必須なものではありません。
例えば、アデノウイルスのE3タンパクは感染細胞の小胞体膜に局在する初期タンパクであるが、宿主のMHCクラスI抗原と結合し、これが細胞表面へ輸送されるのを抑制するためウイルス感染細胞は細胞障害性T細胞の攻撃を免れることになります。
※MHCクラスⅠ
私たちの細胞の表面には、MHCという糖タンパクが細胞1つあたり10万の単位で発現しています。ヒトにおけるMHCはHLA(Human Leukocyte Antigen; ヒト白血球抗原)とよばれます。HLAを規定している遺伝子領域は第6番染色体短腕にあり、タンパクの構造および機能の違いから、クラスI(HLA-A、-B、-C など)、クラスII(HLA-DR、-DQ、-DP など )、クラスIII に分類されています。個体によって細胞表面に発現しているHLA分子は非常に多様性に富んでいます。これにより、自己と非自己(外来の細菌やウイルス)を識別し、免疫反応を開始できます。
ウイルスの生体内での持続
1.急性感染と慢性感染
多くのウイルス感染は臨床的に急性感染症の経過をとるのですが、ウイルスが体内から排除されることなく持続して存在し、慢性感染となることがあります。
慢性感染症はその病態の違いから、これを持続感染と潜伏感染に分けることができる。
持続感染持続感染:
ウイルスが細胞内で増殖し、完全なウイルス粒子が産生されている状態です。
個体レベルではウイルスの排泄があり、感染源となります。
持続感染中、ウイルスは常に宿主の免疫機構にさらされるわけなので、持続感染するウイルスはなんらかの形で、宿主の免疫応答を回避する術をもっているということになります。持続感染するウイルスの最も代表的なものはHIVである。HIVは免疫の中枢に位置するヘルパーTリンパ球を枯渇させ、感染した宿主の免疫機構を破壊するという戦略をとります。HIVの持続感染はウイルスとTリンパ球のフル回転の生産競争を反映した、動的平衡状態の上になりたっています。
持続感染:
本来は急性感染に終わるウイルスが、免疫能が未発達または低下している宿主に感染した場合に起こるものです。
たとえば、B型肝炎ウイルスHBVが新生児期に感染すると90~95%が持続感染となりますし、また、腎臓移植患者でのHBV感染が慢性化しやすいことなどがあげられる。
潜伏感染:
ウイルスのゲノムが感染細胞内に存在するが、感染性のある完全なウイルス粒子は産生されない状態をいいます。潜伏感染するウイルスの最も代表的なものはヘルペスウイルスである。しかし、潜伏感染の詳しいメカニズムはよくわかっていません。
単純へルペスウイルスと水痘・帯状庖疹ウイルスでは知覚神経節に、またサイトメガロウイルスではT細胞や唾液腺細胞に、さらにEBウイルスではリンパ球の一種であるB細胞に潜伏感染します。これらのウイルスは、宿主が強いストレスにさらされたり、免疫能が低下すると直ちに再活性化し、感染性のウイルス粒子が産生され、排泄されます。



コメント