www.biorxiv.org/content/10.1101/2020.06.20.161323v1.full.pdf
こちらを翻訳したいと思います。
抄録
COVID-19は重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)が原因である。SARS-CoV-2の宿主細胞への侵入を媒介するスパイクタンパクは、ワクチンおよび治療薬の主要な標的の1つである。したがって、Sタンパクの配列変異に関する洞察は、SARS-CoV-2の感染および抗原性を理解する鍵となる。ここで、著者らは、Sタンパクの614位に変異体(アスパラギン酸からグリシンへのD614G変異)を観察した。シュードウイルスベースのアッセイを用いて、S‐D614およびS‐G614タンパク偽型ウイルスが共通の受容体、ヒトアンギオテンシン変換酵素2(ACE2)を共有することを見出したが、これはヒトIgG1の融合Fc領域を有する組換えACE2によって遮断され得る。しかし、S‐D614とS‐G614タンパクは機能的差異を示した。まず、S‐G614タンパクをセリンプロテアーゼエラスターゼ‐2によりより効率的に34切断できた。第2に、S-G614シュードウイルス感染293T-ACE2細胞は、回復期COVID-19患者由来の93%(38/41)血清が、S-D614およびS-G614偽型ウイルスの両方を同等の効率で中和することができたが、約7%(3/41)回復期血清は、S-G614シュードウイルスに対する中和活性の低下を示した。これらの知見は、SARS-CoV-2伝播および免疫介入に重要な意味をもつ。
※筆者加筆:
スパイクタンパクとは、下図のコロナウイルスのイメージ画像で、一番外側のとげとげしている部分をいいます。
詳細はこちらのページをご覧ください。
また、遺伝専門医らしく、変異の記載方法について言及しておきます。
D614Gとは614番目のアミノ酸がD(アスパラギン酸)からG(グリシン)に置き換わっているという変異を表現しています。
アミノ酸記号についてはこちらのリンク先を確認してください。
こうしたアミノ酸の変化は一つのDNA塩基が置換されることで起こります。
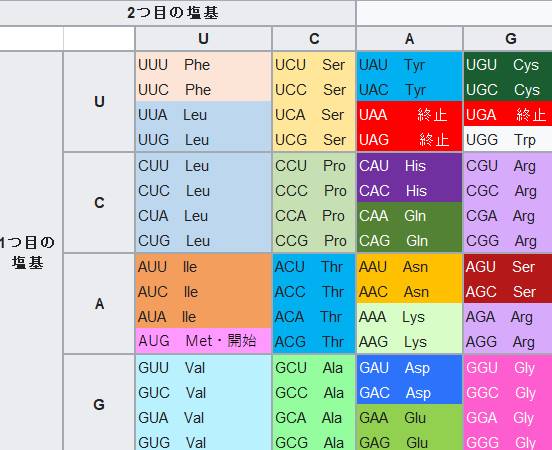
これはRNAがアミノ酸に翻訳されるときのコドン表ですが。
D Asp に対応するコドンは GAU GAC
G Glyに対応するコドンは GGU GGC GGA GGG
なのでDがGになるには、GAUがGGUに置き換わる、または GACがGGCに置き換わる、の2種類の点突然変異(塩基配列の1個が突然変異で変わることを言います)が起こる必要があります。
序文
SARS-CoV-2は2019年に報告された新規コロナウイルスで、最近のコロナウイルス病の大流行-2019年(COVID-19)を引き起こした1。2020年6月17日までに世界保健機関(WHO)は、世界806万人がSARS-CoV-2に感染し、440,290人がCOVID-19で死亡したと報告した。このパンデミックは、国際的な社会的および経済的活動に重大な悪影響を及ぼした。SARS-CoV-2のRNAゲノムの配列を迅速に決定し、診断検査、分子疫学的ソース追跡、ワクチンおよび治療戦略の開発を容易にした2。コロナウイルスはエンベロープをもつプラス鎖RNAウイルスであり、これまでに知られている最大のRNAゲノムをもつ。RNAウイルスの変異率は極めて高く、その伝播および毒性に寄与している可能性がある。SARS−CoV−2スパイク(S)タンパクにおける唯一の有意な変異は、非同義のD614G(アスパラギン酸(D)からグリシン(G))変異3である。一次データは、S-G614が高い伝播効率3を有するSARS-CoV-2のより病原性の株であることを示したが、SタンパクにおけるD614G変換が細胞モデルにおけるウイルス侵入および感染性に影響を及ぼすかどうかは、依然として不明である。
宿主および組織親和性の主要な決定因子であるコロナウイルスのSタンパクは、ワクチン、中和抗体、ウイルス侵入阻害因子の主要な標的である4,5。SARS-CoVと同様に、SARS-CoV-2の細胞受容体はアンジオテンシン変換酵素2(ACE2)である;しかし、SARS-CoV-2 SタンパクはSARS-CoVの対応するSタンパクよりもACE2に対する親和性が10~20倍高いことが報告されている6,7。コロナウイルスは、プロテアーゼを介した細胞表面経路とエンドソーム経路の2つの異なる細胞侵入経路を用いている8。いくつかのコロナウイルスのSタンパクは宿主プロテアーゼによって切断され、感染の侵入段階で受容体結合のためのS1サブユニットと膜融合のためのS2サブユニットになる。フリン、膜貫通プロテアーゼセリン2(TMPRSS2)およびカテプシン(Cat)B/Lを含むいくつかの細胞プロテアーゼは、SARS-CoV-2 SタンパクをプライミングしてACE2を介したウイルスエントリーを増強するのに重要である4。最近、Chandrika Bhattacharyyaらは、SARS-CoV-2変異体のS-G614タンパクに新規セリンプロテアーゼ(エラスターゼ-2)切断部位が導入されたことを報告した9。しかし、細胞モデルにおいてS‐G614タンパクがエラスターゼ‐2によりプロセシングされ活性化されるかどうかは不明である。Sタンパクは、宿主免疫系を回避するためのコロナウイルスの進化において重要な役割を果たす。D614G変異がSタンパクの抗原特性に影響を及ぼすかどうかはまだ不明である。エラスターゼ-2阻害剤およびCOVID-19の回復期血清サンプルがSARS-CoV-2 D614G変異体の感染を阻害できるかどうかは不明である。本研究では、Global Initiative on Sharing All Influenza Data (GISAID)データベースに提出されたSARS-CoV-2のS遺伝子配列を解析した。細胞株におけるS‐D614とS‐G614タンパクの発現と切断を示した。ルシフェラーゼ(訳者注釈:発光する酵素) (Luc)発現レンチウイルス偽型システムを用いて、ウイルスSタンパク変異体によって媒介されるSARS-CoV-2細胞侵入の評価のための定量的シュードウイルスベースのアッセイを確立した8。また、COVID-19患者の回復期血清に対するS-D614およびS-G614タンパクシュードウイルスの中和感受性を比較した。著者らの研究は、この新しく出現したウイルスの伝播および免疫介入に関するさらなる洞察を提供する。
方法
プラスミドC末端19アミノ酸欠失を有するSARS‐CoV‐2Sタンパク(GenBank: QHD43416)をコードするコドン最適化遺伝子をSino Biological Inc. (中国北京)により合成し、pCMV3ベクター(pCMV3‐SARS‐CoV‐2‐S‐C19del、pS‐D614と表記)のKpn IおよびXba I制限部位にクローン化した。D614G変異体S発現プラスミド(pS-G614と表示)を、pS-D614プラスミドを鋳型として、部位特異的変異誘発により構築した。N. Landau10によって構築されたHIV-1 NL4-3 ΔEnV prルシフェラーレポーターベクター(pNL4-3.Luc.R-E-)は、武漢大学(中国武漢)のチェグオカイ教授によって提供された。水疱性口内炎ウイルスG(VSV‐G)発現プラスミドpMD2.Gは、Tsinghua大学(中国、北京)のDing Xue教授によって提供された。ヒトACE2とELANE (エラスターゼ‐2)の発現プラスミドをGenecopoeia (中国広州)から得た。
細胞株
HEK293T細胞は、American Type Culture Collection (ATCC, Manassas, VA, USA)から購入した。10%ウシ胎児血清(FBS; Gibco, Rockville, MD, USA)、100mg/mLのストレプトマイシン、100単位/mLのペニシリンを37℃で5% CO2で添加したダルベッコ変法イーグル培地(DMEM; Hyclone, Waltham, MA, USA)で細胞を培養した。ヒトACE2(293T−ACE2)で感染させたHEK293T細胞を、培地にG418(0.5mg/mL)を添加した同じ条件下で培養した。
抗体と阻害剤
SARS−CoV−2Sタンパクに対する抗RBD (受容体結合ドメイン)モノクローナル抗体は、Chongqin Medical UniversityからProf. Aishun Jinによって提供された。ヒトIgG1のFcドメインに連結した組換えヒトACE2(ACE2-Ig、Sino Biological Inc.)、カモスタットメシル酸塩(東京化学工業、東京、日本)およびアルオキシスタチン(E-64d; MedChemExpress、Monmouth Junction、NJ、米国)を、ストック濃度50mMでジメチルスルホキシド(DMSO)に溶解した。
血清サンプル
2020年2月5日から2月10日までの期間(補足表1)、重研の指定病院3施設から、計41例の回復期COVID-19患者血清(症状発現2~4週後)を採取した。Bioscience Co. (中国、天神)から供給されたMCLIAキットを用いて、すべての血清が陽性であった11。患者血清を56℃で30分間インキュベートし、実験前に補体を不活化した。
SARS-CoV-2ゲノム解析
オンラインネクストストレイン解析ツール(https://nextstrain.org/ncov)を用いて、SARS-CoV-2ゲノムにおけるD614G変異を追跡した。2019年12月20日から2020年6月12日までにサンプリングした2834ゲノムのグローバルを、「長方形」レイアウトを用いて可視化した。変異は枝で標識した。すべてのSARS-CoV-2 S遺伝子の完全な配列は、2020年6月1日にNCBIウェブサイト(https://www.ncbi.nlm.nih.gov/sars-cov-2/)からダウンロードされた。部分配列およびフレームシフト配列を除外した後、4649の完成したS配列を用いて、NCBIから4701のSコード配列を得た。すべてのSヌクレオチド配列をアミノ酸配列に翻訳した。Sのヌクレオチドおよびアミノ酸配列は、複数のシークエンスアラインメントソフトウェアMUSCLEと別々にアラインメントした。「武漢-Hu-1」株(NC_045512)を基準配列とし、民間のPERLスクリプトを用いて変異を抽出した。
SARS-CoV-2 Sタンパク発現のウェスタンブロット解析
細胞におけるSタンパク発現解析するために、S−D614およびS−G614発現プラスミドをそれぞれHEK293T細胞に感染させた。総タンパクは、1mMのフェニルメチルスルホニルフルオリド(PMSF;中国、上海、北京)を含むRIPA Lysis Buffer (CWbiotech、北京、中国)を用いて細胞から抽出した。等量のタンパク試料を、10%ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS-PAGE)によって電気泳動により分離し、次いで、ポリビニリデンジフルオリド(PVDF)膜(Millipore, Billerica, MA, USA)に移した。免疫ブロットは、示された抗体でプローブされた。SuperSignal™ West Pico Chemiluminescent Substrate kits (Bio-Rad, Hercules, CA, USA)を用いてタンパクバンドを可視化し、ImageJソフトウェア(National Center for Biotechnology Information [NCBI]、Bethesda, MD, 155 USA)を用いて濃度測定した。
SARS-CoV-2 Sシュードウイルスの産生と滴定
SARS-CoV-2偽型ウイルスは、既報のようにいくつかの修飾を加えて作製した12。簡潔には、5×106個のHEK293T細胞を、6μgのpNL4−3.Lucで同時トランスフェクトした。製造業者の指示に従い、リポフェクタミン3000トランスフェクション試薬(Invitrogen)を用いたR-Eおよび6μgの組換えSARS-CoV-2 Sプラスミド(pS-D614、またはpS-G614)。細胞を12時間後に新鮮なDMEMに移した。上清中のS-D614およびS-G614タンパクシュードタイプウイルスを、トランスフェクションの48時間後に回収し、遠心分離し、0.45μmフィルターを通してろ過し、-80℃で保存した。pMD2.GをpNL4-3.Lucと同時トランスフェクトした。VSV-GシュードウイルスをパッケージングするためのR-Eplasmid。プライマーとLTR13を標的とするプローブを用いたreal-time (RT)-qPCR法を用いて、ウイルス原液1mLあたりのウイルスRNAゲノム数を測定することにより、シュードウイルスの力価を算出した。
センスプライマー:5′-TGTGTGCCCGTCTGTTGTGT-3’、
アンチセンスプライマー:5′-GAGTCCTGCGTCGAGAGAGC-3’、
プローブ:5′-FAM-CAGTGCGCCGAACAGGGABHQ1-3’。
簡単に述べると、ウイルスRNAをTrizol (Invitrogen, Rockville, MD)で抽出し、RNase-free DNase (Promega, Madison, WI, USA)で処理し、ミニカラムを用いて再精製した。次に、TaqMan One-Step RT-PCRマスターミックス試薬(Applied Biosystems, ThermoFisher)を用いてRNAを増幅した。既知量のpNL4-3.LucR-Evectorを用いて標準曲線を作成した。S-D614およびS-G614タンパク偽型ウイルスを、以下の実験のために同じ力価(コピー/ml)に調整した。SARS-CoV-2スパイク媒介シュードウイルスエントリーアッセイS変異体媒介ウイルス侵入を検出するために、96ウェルプレートで増殖させた293T−ACE2細胞(2×104)を、それぞれ同量のS−D614またはS−G614シュードウイルス(50μL中3.8×104コピー)でトランスフェクトした。細胞を感染8時間後に新鮮なDMEM培地に移し、Luciferase Assay Reagent (Promega, Madison, WI, USA)により、製造業者のプロトコールに従って感染24~72時間後に相対的発光単位(RLU)を測定した14。
中和および阻害アッセイ
293T−ACE2細胞(2×104 細胞/ウェル)を96ウェルプレートに播種した。中和アッセイのために、3.8×104ベクターゲノムに相当する50μLのシュードウイルスを、患者由来の血清サンプルおよび陰性対照としてのヒト正常血清の連続希釈物と共に37℃で1時間インキュベートし、次いで、3回の複製で96ウェル293T−ACE2細胞に添加した。阻害アッセイのために、細胞を感染2時間前にプロテアーゼ阻害剤(メシル酸カモスタットまたはE-64d)で前処理した。12時間のインキュベーション後、培地を新鮮な細胞培養培地に置き換えた。ルシフェラーゼ活性は感染72時間後に測定し、中和率はGraphPad Prism 6.0ソフトウェア(GraphPad Software, San Diego, CA, USA)を用いて算出した。RLU減少率(阻害率)は、1(試料血清のRLU-対照ウェル)/ (模擬対照血清からのRLU-対照ウェル)) X100%として算出した。中和抗体の力価は50%阻害用量(ID50)として算出した。
統計解析
データの統計解析は、GraphPad Prism version 6.0ソフトウェアを用いて行った。多重比較にはANOVAを用いて統計学的有意性を判定した。2群の比較にはStudentのt検定を適用した。P値<0.05の差は統計的に有意とみなした。
倫理的承認
なお、本研究は重研医科大学倫理委員会の承認を得ており(参考文献番号2020003)、同意書は新興感染症指定病院の倫理委員会より免除された。
結果
SARS‐CoV‐2スパイクタンパクのD614G変異は、1273アミノ酸を含むSARS‐CoV‐2のスパイク(S)タンパクが、ウイルス侵入に必須の役割を果たすビリオン表面上に三量体スパイクを形成した。GISAIDデータベースのウイルスゲノム配列からSARS-CoV-2 Sたんぱく質アミノ酸配列を解析した。これまでの報告と一致して、全般的に分布するSタンパク変異、D614~G614が見つかり、解析した全配列の64.6%に相当した(図1および表1)。Sタンパクで観察された上位10個の最も豊富な非同義変異の中で、D614G変異体(クレードG)の相対的な存在量は世界中で最も高く、G614株が選択的に有利であり得ることを示した。
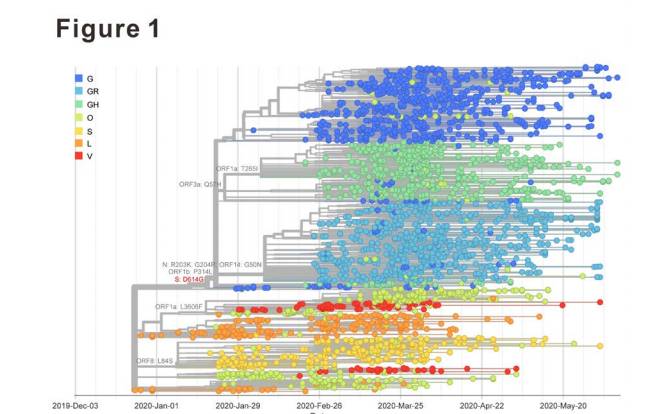
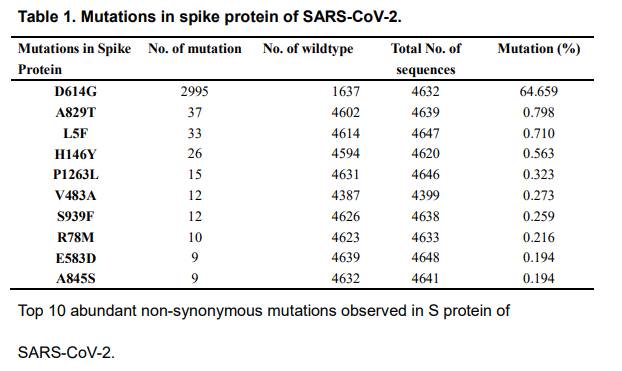
D614G変異の影響
Sタンパクはコロナウイルス感染に重要であるので、本発明者らは、Sタンパクの発現および機能に対する最も一般的なD614G変異の影響を探求した。
D614G変異によるプロテアーゼの切断は、PROSPER15によるSタンパク変異体のプロテアーゼの潜在的切断部位を増強し、S-G614タンパクのS1-S2接合領域の615-616残基に新規セリンプロテアーゼ(エラスターゼ-2)切断部位を見出した(図2a、231補足表2)。ヒト細胞株におけるSARS−CoV−2Sタンパクの発現および切断を評価するために、コドン最適化S発現プラスミド(pS−D614およびpS−G614)をそれぞれHEK293T細胞にトランスフェクトした。全細胞溶解物のイムノブロット分析により、S-D614およびS-G614タンパクの両方が、SARS-CoV-2スパイク上のRBDを標的とするモノクローナル抗体と反応した場合、2つの主要なタンパクバンド(未処理Sおよび切断S1サブユニット)を示すことが明らかになった(図2b)。
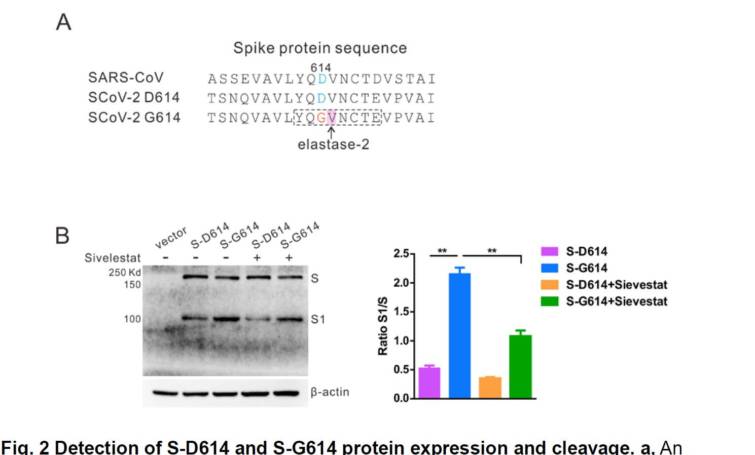
a. SARS‐CoV‐2のS‐614Gタンパク中にS1‐S2接合部の追加のセリンプロテアーゼ(エラスターゼ‐2)切断部位533が見いだされた。b.抗RBDモノクローナル抗体を用いたウェスタンブロットによるHKE293T細胞中のSタンパク発現の検出。細胞をpS-D614、pS-G614プラスミドまたは空のベクターでトランスフェクトし、シベレスタットナトリウムとインキュベートするか否かを調べた。S1とS比を比較するために、S1/Sの積分密度をImageJソフトウエアを用いて定量的に解析した。有意差を一元配置分散分析で解析した。**P < 0.01.
ウイルス侵入に対するD614G変異の影響
S-D614とS-G614シュードタイプレンチウイルス粒子間のウイルス侵入効果を評価するレンチウイルスベクターは、細胞親和性と細胞侵入特性を調節する様々な異種ウイルス糖タンパクを用いて偽型化することができる16。SARS-CoV-2は病原性が高いため、感染性のSARS-CoV-2はバイオセーフティレベル3(BSL-3)施設で取り扱わなければならない。著者らは、レンチウイルス系を用いてウイルスSタンパクに基づく偽型SARS‐CoV‐2を作製し、これはコロナウイルスS媒介エントリーの定量のためのLucレポーター遺伝子を導入した。pNL4-3.Luc.R-E254は、それぞれpS-D614、pS-G614と共同トランスフェクションを行い、HEK293T細胞にSARS-CoV-2 S疑似型単ラウンドLucウイルスを同梱した。S−D614およびS−G614タンパク偽型ウイルスの力価を、ミリリットル当たりのウイルスRNAゲノムの数として表されるRT−qPCRによって決定し、次いで、以下の実験のために同じ濃度(50μL中3.8×104 258コピー)に調整した。ウイルス感染能は、RLUで発現させたLucアッセイにより測定した。ヒトACE2(293T−ACE2)を発現するHEK293T細胞を使用して、ACE2発現とシュードウイルス感受性との間の相関を試験した。対照としてVSV-G pseudovirusを用いた。図3aに示すように、HEK293T及び293T-ACE2セルは共にVSV-G疑似ウィルスによって効果的にトランスデュースできる。しかしながら、S-D614およびS-G614シュードウイルスの侵入は、その細胞受容体ACE2発現に高度に依存している。293T−ACE2細胞は、S−D614およびS−G614シュードウイルスによってそれぞれ形質導入された場合、HEK293T細胞と比較して、Luc活性において約250倍および530倍の増加を示した(図3a)。次に、C末端のヒトIgG1のFc領域に連結したヒトACE2の細胞外ドメイン(Met 1-Ser 740)からなる融合タンパクであるACE2-Igの阻害能を検出した17。S-D614およびS-G614シュードウイルスはいずれもACE2-Igにより強力に阻害され、IC50(シュードウイルス感染の50%阻害を引き起こす濃度)はそれぞれ0.13および0.15μg/mLであった(図3b)。S変異体を介したウイルス侵入効率をさらに比較するために、感染後の異なる時期にLuc活動を検出した。G614 Spike変異体では、D614変異体よりもウイルス形質導入の増加は、感染後48時間で2.2倍であった。最も高い形質導入効率(約2.5×10 276 4 RLU)は、S-G614 pseudovirusによる感染72時間後に観察され、これはS-D614 pseudovirusよりも約2.4倍高かった(図3c)。これらのデータは、SタンパクにおけるD614G変異がACE2発現細胞へのウイルス侵入を有意に促進し、ACE2‐Igが野生型および変異S偽型ウイルス感染の両方を効率的に遮断することを示唆した。次に、S-G614がシュードウイルス感染能を増大させる機序を探った。
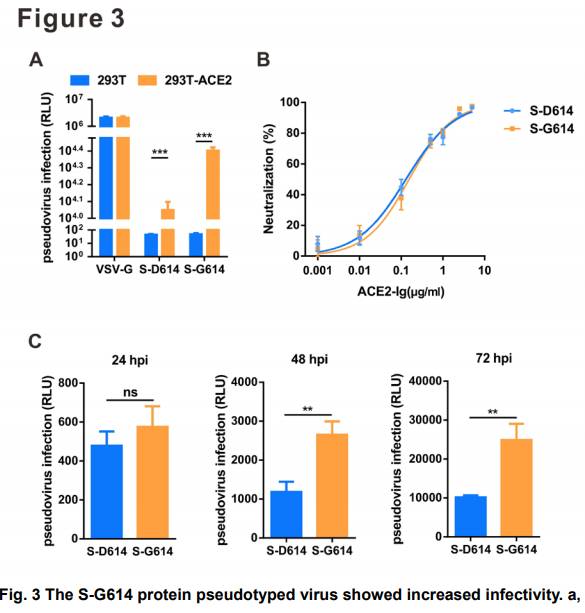
プロテアーゼ阻害剤はS-G614シュードウイルスの感染を遮断した
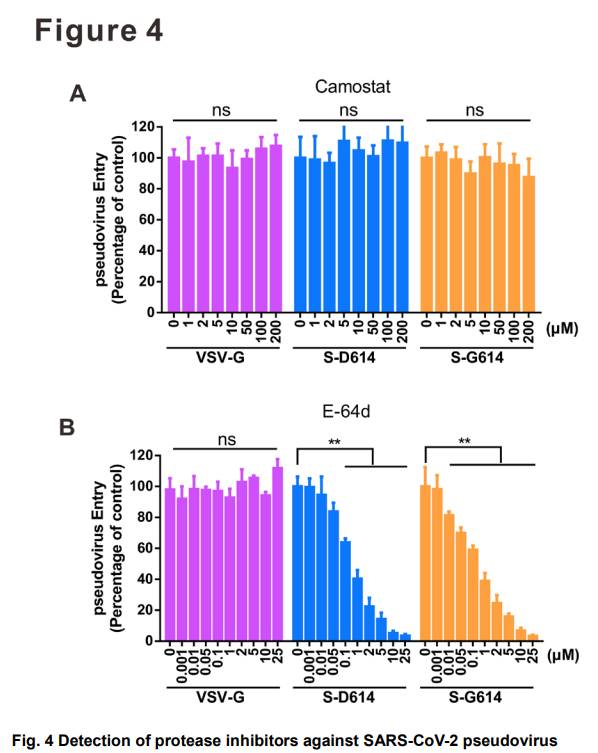
Sタンパクのタンパク分解活性化はコロナウイルス感染能に必要であり、プロテアーゼ媒介細胞表面経路はSARS-CoV-2侵入に重要である。本発明者らは、293T細胞において外因的に発現される場合、S−G614が宿主プロテアーゼによってより効率的に切断され得ることを観察したので、本発明者らは、宿主プロテアーゼが、S−G614ウイルス侵入の増強に関与し得ることを仮定した。2つの臨床的に証明されたプロテアーゼ阻害剤、それぞれ宿主TMPRSS2とCatB/Lを遮断するメシル酸カモスタットとE‐64dを、S‐D614とS‐G614タンパク偽型レンチウイルス粒子で試験した。図3aに示すように、TMPRSS2を欠く293T-ACE2細胞において、セリンプロテアーゼ阻害剤カモスタットメシレートは、S-D614またはS-G614シュードウイルス感染を阻害しなかった。一方、システインプロテアーゼ阻害剤E-64dはこれら2つのシュードウイルスの侵入を有意に遮断し、IC50はS-D614シュードウイルスで0.37μM、S-G614シュードウイルスで296 0.24μMであった(図3b)。予想通り、これらのプロテアーゼ阻害剤はVSV-Gシュードウイルス感染に影響を及ぼさなかった。総合すると、これらの結果は、TMPRSS2欠損293T‐ACE2細胞へのS‐メディテートウイルス侵入がエンドソームシステインプロテアーゼCatB/L依存性であり、したがってS‐D614およびS‐G614シュードウイルスが293T‐ACE2細胞におけるCatB/L阻害剤E‐64dと同様の感受性を示すことを示唆した。
回復期のCOVID-19患者血清のS-D614およびS-G614シュードウイルスに対する中和効果
中和抗体は、ウイルス感染の予防およびおそらく回復に重要であるが、ウイルスは複製および拡散の間に変異するため、感染初期に生じた宿主中和抗体は、後にはそれほど有効ではないかもしれない18,19。D614G変異がウイルスの中和感受性に影響するかどうかを試験するために、SARS-CoV-2 S-D614およびS-G614シュードウイルスに対するCOVID-19を有する回復期患者由来の血清試料の中和活性を評価した。中和アッセイを行うために、50μlのシュードウイルス(3.8×104コピー)を連続希釈血清と共にインキュベートした。図4aに示すように、回復期COVID-19患者からの血清の阻害率を、1:1000の単一希釈で分析した。検査した41の血清の中で、そのうちの38はS‐D614およびS‐G614シュードウイルスの両方に対して同等の効率で中和活性を示した。特に、3つの血清サンプル(患者1#、7#、40#)は、S-G614シュードウイルスに対する阻害率を低下させた。患者1#の血清は、1:1000希釈でS-D614シュードウイルスの約30%を中和したが、S-G614シュードウイルスを中和できなかった。次に、回復期患者5名と健康ドナーの血清サンプルについて、阻害曲線とID50を分析した。患者17#および39#の血清は、2つの偽型ウイルスをほぼ同じ程度に中和することができ、同様のID50値を示した(図4b)。しかし、患者1#、7#及び40#の血清は、ID50が894~1337のS-D614 323シュードウイルスに対して高い中和活性を示したが、ID50が216~367のS-G614シュードウイルスに対する中和活性を低下させ、中和力価の3.6~4.7倍の低下を示した(図4b)。これらのデータは、D614G変異がSタンパクの抗原性を変化させ、それによって個々の回復期血清に対する中和感受性を低下させることを示した。
考察
シュードウイルスベースのアッセイは、細胞親和性、受容体認識、ウイルス阻害剤、およびBSL-3研究室の必要なしに中和抗体の評価の研究のために広く使用されてきた。本研究では、レンチウイルス系を用いてウイルスSタンパクに基づく偽型SARS‐CoV‐2を作製し、これはコロナウイルスS媒介エントリーの簡易定量のためのLucレポーター遺伝子を組み込んだ。著者らは614位のSタンパクの主要な変異を研究し、セリンプロテアーゼエラスターゼ‐2がS‐G614タンパクのタンパク分解活性化に関与し、それにより293T‐ACE2細胞へのウイルス侵入を増強することを見出した。さらに、S-G614シュードウイルスは、S-G614シュードウイルスよりも中和抗血清に対する耐性が高いことを見出した。本研究では、S‐G614偽型ウイルスの侵入効率は、標準化されたインプットウイルス用量の場合、S‐D614シュードウイルスのそれより約2.4倍高いことを見出し、D614G変異がSARS‐CoV‐2の感染性を促進し、ウイルス伝播性を増強することを示唆した。シュードウイルスは単回感染試験であったため、このように侵入活性がわずかに上昇すると、in vivoでのウイルス感染能に大きな差が生じる可能性がある。Hangping Yaoらは、D614G変異を保有する患者由来のウイルス分離株ZJU-1が、Vero-E6 cells20に感染した場合、分離株ZJU-8(S-D614を保有する)よりも19倍高いウイルス負荷を有することを報告した。しかしながら、ZJU-1分離株は、ORF1aおよびエンベロープ(E)遺伝子における他の2つの非同義変異を含む。我々の結果はまた、SARS-CoV-2プロテアーゼ切断部位のSタンパクにおけるD614G変異の関連についてのいくつかの説明を提供し、従って、それは、宿主エラスターゼ-2によってより効率的に切断され得る。これまでのSARS-CoVに関する研究では、プロテアーゼを介した細胞表面への侵入は、プロテアーゼが存在しない場合にエンドソーム経路よりも100~1000倍高い効率的な感染を促進することが実証された21。好中球エラスターゼとしても知られるエラスターゼ-2は、変性疾患および炎症性疾患において重要な役割を果たす。シベレスタットは、急性呼吸窮迫症候群(ARDS)の治療薬として日本と韓国で承認されており、全身性炎症反応症候群を有するARDS患者の肺機能に有益な効果をもたらしています22。COVID-19患者の約10~15%がARDS23に進行するため、シベレスタートは肺結合組織への好中球エラスターゼの損傷を軽減するだけでなく、Sタンパクプロセシングを阻害することによってウイルス拡散能を制限する可能性があることから、Mahmoud M. A. Mohamedらは、高リスクCOVID-19患者24における好中球誘発損傷を軽減するためのシベレスタートの使用を提唱した。我々の結果は、S-G614タンパクがより効率的に切断されることを示した。これは、S-G614タンパクのS1-S2接合領域上の新規エラスターゼ-2切断部位に起因する可能性があるため、D614G変異を有するSARS-CoV-2によって引き起こされるCOVID-19の治療のための有効な選択肢である可能性があることを示した。小山らは、D614GがSARS-CoV-2 Sタンパクの予想されるB細胞エピトープの1つに位置し、これは2003年にSARS-CoVのSタンパクにおいて高度に免疫優性の領域であるD614が保存されていることを報告した。SARS-CoVにおけるこれまでの研究から、ペプチドS597-625はヒトにおける主要な免疫優性ペプチドであり、SARS-CoV25の自然感染後に長期B細胞記憶反応を誘発することが示唆された。SARS−CoV−2Sタンパクのアミノ酸614と621との間の領域もまた、異なる方法によってB細胞エピトープとして同定され、そしてD614Gの変化は、この領域26の抗原性に影響し得る。ここで、回復期血清の7%(3/41)がS‐G614とS‐G61タンパク偽型ウイルス間で著しく異なる中和活性を示したことを観察し、D614G変異が中和抗体感受性を低下させることを示した。これらの患者がS-G614変異型の再感染リスクが高いかどうかは、さらなる研究で探索されるべきである。また、ワクチン誘発中和抗体の中和能の幅を明らかにすることも重要であろう。ごく最近、いくつかのグループが、S-G614がシュードウイルスアッセイ27-29に基づいてウイルス感染能を増強することも報告したが、サンプルサイズが小さいため、ウイルスの中和感受性に影響を及ぼさないことがわかった27,28。SARS−CoV−2 RNAゲノムの進化する性質を考慮すると、抗体処理およびワクチン設計は、D614Gおよびウイルスの免疫原性に影響を及ぼし得る他の変異に適応するためにさらなる考慮を必要とし得る。我々の研究にはいくつかの限界がある。第一に、SARS-CoV-2 Sタンパクシュードタイプウイルスのパッケージング効率を改善するためにSタンパクのC末端19アミノ酸が不足しており、このシュードウイルスはウイルス侵入イベントを再現するのみであったため、本物のSARS-CoV-2による追加のアッセイが必要である。第二に、Sタンパクに対する中和抗体のみを試験した。しかし、SARS-CoVに関するこれまでの研究では、SARS-CoV抗原に特異的な記憶B細胞のごく一部は、Sタンパク上に存在する中和エピトープに対するものであることが示された30。第3に、D614Gに加えて、SARS-CoV-2感染、病原性および免疫原性に対するそれらの影響を評価するために、Sタンパクにおける他の変異についてのさらなる研究が必要である。これらの変異がCOVID-19の重症度に及ぼす影響を明らかにするためには、さらなる研究が必要である。要約すると、SARS-CoV-2スパイク媒介シュードウイルス侵入アッセイを確立し、S-D614およびS-G614偽型ウイルスの細胞侵入を検討した。我々の研究は、D614G変異がSタンパクに追加のエラスターゼ-2切断部位を導入し、それによってその切断およびウイルス細胞侵入を促進し、より伝達性のSARS-CoV-2をもたらすという証拠を提供した。重要なことに、D614G変異は、個々の回復期COVID−19患者において、血清中和抗体に対するウイルスの感受性を低下させた。本試験は、SARS-CoV-2伝播およびCOVID-19に対するワクチンおよび治療介入のデザインの理解に役立つであろう。
関連記事
いかがでしたか?
今回の報告は,SARS-cov-2が抗体のエピトープとなる部位に変異を来すことで感染性が増強した株がある、というものです。
ウイルスはこうして変異しながら進化を遂げます。
細菌も。
感染制御策などは今までと全く同じです.



コメント