www.nature.com/articles/s41591-020-0965-6
こちらに掲載された論文を和訳いたします。
無症候性SARS-CoV-2感染症の臨床的および免疫学的評価
抄録
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に感染した無症候性患者の臨床的特徴および免疫応答は、十分に記述されていない。われわれは、RT-PCRで確認されたSARS-CoV-2感染症と診断されたが、先行する14日間および入院中に関連する臨床症状が全く認められなかった和州地区の無症候性患者37例を対象とした。無症候性の人は、集中隔離のために政府指定の和州人民病院に入院した。無症候群におけるウイルス排泄期間の中央値は19日(四分位範囲(IQR)、15~26日)であった。無症候群は、症候群よりもウイルス排泄期間が有意に長かった(log-rank P = 0.028)。無症候群のウイルス特異的IgG濃度(S/CO中央値、3.4; IQR、1.6~10.7)は、急性期の症候群(S/CO中央値、20.5; IQR、5.8~38.2)と比較して有意に低かった(P = 0.005)。無症候性患者のうち、93.3%(28/30)および81.1%(30/37)が回復期初期にそれぞれIgGおよび中和抗体レベルの低下を示したのに対し、症候性患者では96.8%(30/31)および62.2%(23/37)であった。無症候性個体の40%が血清陰性となり、症状のある群の12.9%が回復早期にIgG陰性となった。加えて、無症候性の個人は、より低いレベルの18の炎症誘発性および抗炎症性サイトカインを示した。これらのデータは、無症候性の個人はSARS-CoV-2感染に対する免疫応答が弱かったことを示唆している。回復期初期におけるIgGおよび中和抗体レベルの低下は、免疫戦略および血清学的調査に意味があると考えられる。
主
2020年5月24日現在、SARS-CoV-2によるコロナウイルス病2019(COVID-19)のパンデミックは、世界中で500万人以上が罹患しています。SARS-CoV-2感染患者のほとんどは、発熱、咳、息切れなどの症状を伴う軽度から重度の呼吸器疾患を有していると報告されており、暴露後2~14日で出現する可能性がある。しかしながら、RT-PCR検査陽性により診断されるが、無症候性または症状がほとんどない患者たちも存在する2,3,4,5,6. 。無症候性の個体がウイルスを効率的に広げることができること、およびSARS−CoV−2のこれらのサイレントスプレッダーの出現が、流行制御における困難を引き起こしたことが、証拠の増加によって示されている。しかし、SARS-CoV-2感染症の無症候性患者の臨床的特徴および免疫応答に関する我々の理解は限られている2,5。本稿では、37人の無症候性患者における疫学的および臨床的特徴、ウイルスレベルおよび免疫応答について述べる。
結果
人口統計学的特性
2020年2月6日、中国のNational Health Commission of ChinaはCOVID-19 Prevention and Control Plan (第4版)を更新し、無症候性個人の特定と隔離を重視して密接な接触者の管理を行った1。無症候性の個人を同定するために、和州疾病管理予防センター(CDC)はその後、隔離下で2088人の密接な接触者に対する広範なRT-PCRスクリーニングを実施した。次に、RT-PCRの結果が陽性であった個人を、地域のCDCが実施した点有病率調査および臨床医が報告した症状アセスメントによってスクリーニングした。このうち60名は、地域のCDC記録によれば、前の14日間に症状がないと主張し、中央隔離のために政府指定病院に移された。入院時、臨床医によって報告された症状評価に基づいて、17人が軽度または非定型症状のために除外された;入院後4~17日で症状を発症した6人も除外された。最後に、核酸検査結果が陽性であるが、過去14日間および入院中に関連する臨床症状が認められないと定義された37例の無症候性症例を本研究に含めた。CDCサーベイランスシステムによって追跡されたように、2020年4月10日以前に和州地区でSARS-CoV-2感染が確認された患者は合計178人であった。本試験では、無症候性感染患者の割合は20.8%(37/178)であった。
抗体検出およびサイトカイン測定のために、無症候性患者との比較のために、性別、年齢頻度および併存症をマッチさせた軽度の症候性患者37例を選択した(補足表1)。SARS-CoV-2に対するRT-PCRの結果が陰性であった和州地区の性別および年齢頻度を一致させた対照個体37個体も、サイトカイン比較のために選択した。
無症状の37人のうち、年齢中央値は41歳(範囲、8~75歳)、22人が女性であった。28名はRT-PCRで確認されたCOVID-19患者との接触歴が確認されており、9名は武漢研修医であるか、感染発症以前に武漢への渡航歴があった(補足表2)。
放射線学的および検査所見
China7のNational Health CommissionからのCOVID-19 Treatment Guidelines (第5版)に従い、入院時に全血球算定、血液生化学検査、凝固機能、肝機能および腎機能、感染バイオマーカーを測定し(補足表2)、潜在的な疾患進行をモニタリングした。無症候性の37人のうち、3人はリンパ球減少症、1人は血小板減少症であった。6人はアラニンアミノトランスフェラーゼのレベルが上昇しており、11人はC反応性タンパクレベルが上昇していた。
入院時、胸部コンピュータ断層撮影(CT)スキャンでは、11人の無症候性患者(11/37、29.7%)で巣状スリガラス陰影、10人(10/37、27.0%)で縞状陰影および/またはびまん性硬化が示されたが、16人(16/37、43.2%)では異常は認められなかった(図1)。5名が入院5日以内に胸部CTで限局性すりガラス陰影または縞状陰影を発症した。胸水、気管支造影所見及びリンパ節腫大は認められず、8 , 9 , 10の重篤な症状を呈した患者に認められた典型的な変化であった。片肺に限局した異常放射線学的所見は、無症候性者の66.7%(14/21)で同定されたが、33.3%(7/21)は両肺に異常があった。
図1:無症候性患者2例の胸部CTスキャン。
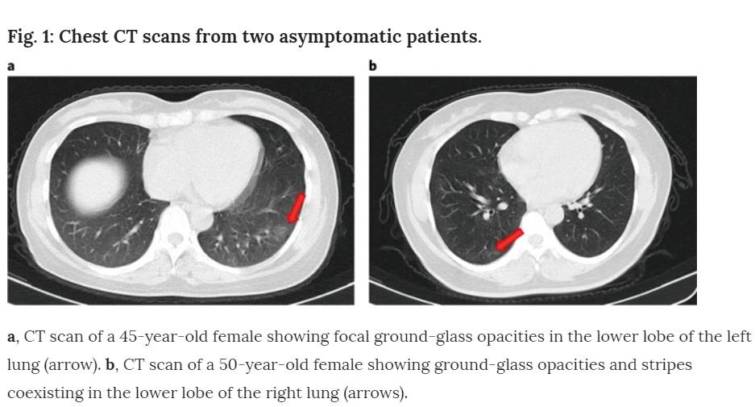
a, 左肺下葉に限局性すりガラス陰影を示した45歳女性のCTスキャン(矢印)。b, 右肺下葉に共存するすりガラス様陰影と縞を示す50歳女性のCTスキャン(矢印)。
ウイルス学的転帰
無症候性患者37例および症候性患者37例全例について、最初の鼻咽腔スワブ陽性のRT-PCRサイクル閾値(Ct)値を比較した。37名の無症候性個体および37名の症候性患者の初期Ct値は類似していた(ORF1b 32.8(IQR,30.9~35.8)対31.7(IQR,30.3~35.1), P = 0.336; N 32.6(IQR,29.5~34.6)対33.5(IQR,31.3~37.2), P = 0.126)(図2a)。
無症候性患者における最初の鼻咽腔スワブ陽性から最後のスワブ陽性までの間隔と定義したウイルス排泄期間の中央値は19日(IQR、15~26日)であった。ウイルス排泄の観察期間が最も短かったのは6日であったが、最も長かったのは45日であった。ウイルス排泄期間の中央値は、症状が軽度の患者では14日(IQR、9~22日)であった。無症候群は、症候群よりもウイルス排泄期間が有意に長かった(log-rank P = 0.028)(図2b)。しかしながら、測定可能なウイルス排泄はウイルス感染能と同等ではなく、培養可能なウイルスと相関する呼吸器SARS-CoV-2ウイルス量を測定するためには更なる評価が必要である11。
図2:無症候性および症候性症例におけるウイルス学的特性。
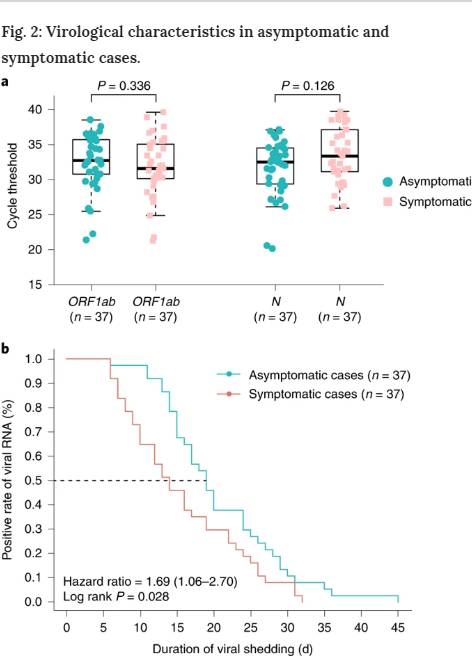
a, 無症候性(n = 37)群および症候性(n = 37)群の鼻咽腔スワブで検出されたRT-PCR法で得られたORF1bおよびNのCt値。ボックスプロットは、中央値(中央線)ならびに第1および第3の四半分(ボックス)を示し、一方、ウィスカーは、ボックスの上下のIQRの1.5倍を示す。対応のない両側Mann-WhitneyのU検定P値をプロットに描き、有意なP値カットオフ値を0.05としたb、ウイルスRNAの陽性率の推定にはKaplan-Meier法を用い、両側log-rank検定を適用し、症候群と無症候群におけるウイルス排泄期間の有意差を評価した。
無症候性患者におけるウイルス特異的IgGおよびIgM
SARS-CoV-2感染に対する急性抗体反応を調べるため、無症候性および症候性の個人の血清サンプルにおいてウイルス特異的IgGおよびIgMを測定した。無症候群では、81.1%(30/37)がIgG陽性であり、症状のある群の83.8%(31/37)が曝露から約3~4週間後にIgG陽性であった。さらに、無症候群の62.2%(23/37)はIgM陽性であったが、症候群の78.4%(29/37)はIgM陽性であった。興味深いことに、症候群(S/CO中央値20.5; IQR、5.8~38.2)のIgGレベルは、急性期(呼吸器標本でウイルスRNAが見つかる期間)の無症候群(S/CO中央値3.4; IQR、1.6~10.7)よりも有意に高かった(P = 0.005)(図3a)。
図3:SARS-CoV-2感染患者における急性期および回復期のIgGおよびIgM濃度。
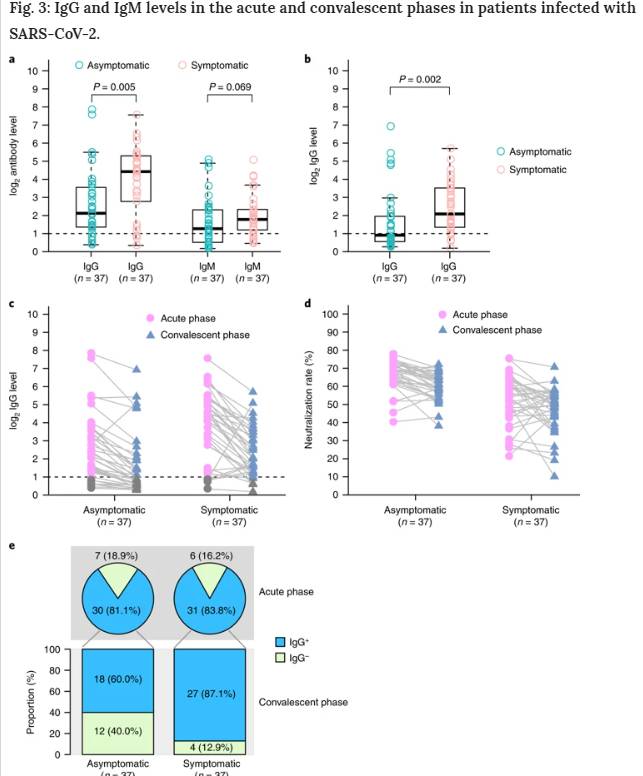
a, 急性感染症の無症候性患者(n = 37)と症候性患者(n = 37)におけるウイルス特異的抗体レベルの比較b, 退院した回復期COVID-19患者のIgG値c, 急性期および回復期におけるウイルス特異的IgG濃度の動的変化d, 急性期および回復期における中和血清抗体の動的変化結果は2つの独立した実験の平均として表される。e, 急性期および回復期のCOVID-19患者のIgG陽性割合aおよびbのボックスプロットは、中央値(中央線)ならびに第1および第3の四半分(ボックス)を示し、ウィスカーは、ボックスの上下のIQRの1.5倍を示す。対応のない両側Mann-WhitneyのU検定P値をプロットに描き、有意なP値カットオフを0.05とした。
また、無症候性患者37名、症候性患者37名を早期回復期(退院後8週間)に追跡した。症候性群のIgG濃度は、回復期初期においても無症候性群よりも有意に高かった(P = 0.002)(図3b)。驚くべきことに、無症候群の93.3%(28/30)と症候群の96.8%(30/31)のIgGレベルは回復期初期に低下した(図3c)。減少率の中央値は、無症候性群のIgGレベルで71.1%(範囲、32.8~88.8%)であったが、症候性群では76.2%(範囲、10.9~96.2%)であった。また、シュードウイルスベースの中和アッセイ(方法)を用いて、無症候性群の81.1%(30/37)および症候性群の62.2%(23/37)で中和血清抗体レベルの低下を観察した。減少率の中央値は無症候群の中和血清抗体では8.3%(範囲、0.5~22.8%)であったが、減少率の中央値は症候群では11.7%(範囲、2.3~41.1%)であった(図3d)。さらに、無症候性患者の40.0%(12/30)がIgGに対して血清陰性となったが、症候性患者ではわずか12.9%(4/31)であった(図3e)。
無症候性個体のサイトカイン
SARS-CoV-2感染に関連する免疫応答をさらに解明するために、血清サイトカインおよびケモカイン濃度を無症候性群と症候性群の間で比較した。無症候群と比較して、症候群では18種類の炎症誘発性および抗炎症性サイトカインの濃度の上昇が観察された。このうち、腫瘍壊死因子関連アポトーシス誘導リガンド(TRAIL) (P = 3.39×10−14)、マクロファージコロニー刺激因子(M-CSF) (P = 5.08×10−13)、増殖調節がん遺伝子-α (GRO-α) (P = 1.5×10−10)、顆粒球コロニー刺激因子(G-CSF) (P = 2.05×10−9)およびインターロイキン6(IL-6) (P = 6.33×10−9)が最も有意な変化を示した(図4および拡大資料図1)。さらに、サイトカインを無症候性群と37人の健常対照者でさらに分析した。32種のサイトカインの血漿レベルは健常対照者と無症候性者の間で類似していた。無症候群では、幹細胞因子(SCF) (P = 1.48×10−9)、IL-13(P = 3.75×10−7)、IL-12 p40(P = 7.08×10−6)、白血病抑制因子(LIF) (P = 1.33×10−3)が有意に高値であった(拡大資料図2)。まとめると、我々のデータは、無症候性の個人が、低い循環濃度のサイトカインおよびケモカインによって特徴付けられる炎症反応の低下を有していたことを示している。
図4:無症候性群と症候性群の血清サイトカイン/ケモカイン濃度の比較。
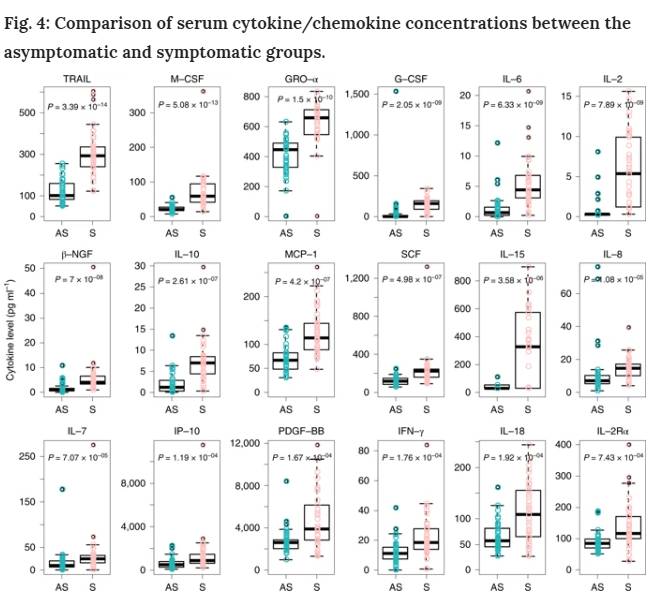
無症候性(n = 37)および症候性(n = 37)のCOVID-19患者のサンプルを入院中の急性期に採取し、48種類のサイトカインおよびケモカインの濃度を測定するためにアッセイを実施した。ボックスプロットは、中央値(中央線)ならびに第1および第3の四半分(ボックス)を示し、ウィスカーは、ボックスの上下のIQRの1.5倍を示す。対応のない両側Mann-WhitneyのU検定P値をプロットに描き、有意なP値カットオフを0.001とした。
考察
SARS-CoV-2に感染した無症候性患者の臨床的特徴および免疫応答は十分に記述されていない。臨床検査で確認された178例の患者のうち、疾患経過を通して何ら症状を発症しなかった37例を本試験の対象とした。我々のデータは、これらの患者の20.8%が無症候性感染症であったことを示した。しかしながら、これは、無症候性感染が感染の危険性が高い人(密接な接触者や武漢への旅行歴のある人を含む)から同定されたものであり、無作為に抽出された人からではないため、一般集団における無症候性感染の比率を正確に推定するものではないかもしれない。したがって、無症候性感染の割合は、集団スクリーニングを通して決定する必要がある12.。さらに、RT-PCR検査で見逃される症例もあるため、無症候性感染の割合はさらに高くなる可能性がある。我々のグループは、RT-PCRの結果が陰性で、抗体検査を用いることで症状がない148例からSARS-CoV-2感染患者7例を同定することに成功している13。したがって、時宜を得たRT-PCRと血清学的検査を併用すべきであり、これは無症候性の割合の正確な推定に有益である。しかし、血清学的検査には限界があり、検査の特異度や感度は様々である。結果は、SARS-CoV、MERS-CoVまたは感冒コロナウイルスに対する以前から存在していた抗体によっても交絡する可能性がある。
現在までのところ、SARS-CoV-2 RNA排泄の期間は十分に特徴付けられていない。SARS-CoVでは、咽頭ぬぐい液、便、尿など様々な検体からウイルスRNAが検出され、30%以上の患者で発症後4週間にわたって検出された14。MERS-CoV感染症では、呼吸器分泌物中のウイルス排泄が少なくとも3週間持続した15。最近、COVID-19患者191人を対象とした1件の研究では、ウイルス排泄期間の中央値は生存者で20日(範囲:8~37日)であったと報告された16。別の報告では、シンガポールでSARS-CoV-2に感染した患者18例において、鼻咽腔吸引液中のウイルス排泄期間が症状発現後少なくとも24日まで延長した 17。本研究では、軽度の症状を呈した37例におけるウイルス排泄期間の中央値は14日であり、これまでの報告よりも短かった。症候性患者と比較して、無症候性群はウイルス排泄期間が有意に長く、ウイルス排泄時間は19日であった。疾患の重症度、ウイルス排泄期間の定義、検体採取の頻度など、いくつかの因子が、様々な研究におけるウイルス排泄期間の変動に寄与している可能性がある。特に、ウイルスRNAの検出は必ずしも呼吸器検体中に感染性ウイルスが存在することを意味するものではなく、感染の可能性を評価するためにRT-PCRに基づいて算出したウイルス排泄期間を適用する場合には注意が必要である。
感染後の免疫の強さと持続時間は、「遮蔽免疫」18の重要な問題であり、身体的距離制限をどのように、どのタイミングで緩めるかを決定するための重要な情報19,20となる。これまでの研究では、SARS-CoVまたはMERS-CoVに対する循環血中の抗体が少なくとも1年間は21,22. 続くことが示されている。SARS-CoV感染23,24以降、持続的なIgG濃度が2年間以上維持された。実験室で確認されたMERS-CoV感染者における抗体反応は、アウトブレイク後少なくとも34ヵ月間持続した25。近年、SARS-CoV-2感染に対する適応免疫反応を特徴づけるいくつかの研究により、ほとんどのCOVID-19回復期の個人が検出可能な中和抗体を有し、これはウイルス特異的T細胞数26,27,28,29と相関することが報告されている。本試験では、SARS-CoV-2感染から回復した人の高割合でIgG濃度と中和抗体が感染後2~3カ月以内に低下し始めることを観察した。COVID-19の回復期患者8例における中和抗体価の動態について、4例が発症後約6~7週で中和抗体の減少を示した30別の報告もある。また、SARS-CoV-2感染後の免疫持続期間が短いことを示唆する数学モデルも1つある31。これらのデータを総合すると、COVID-19「免疫パスポート」を使用するリスクが示され、ソーシャルディスタンス、衛生、高リスク群の隔離および広範な試験を含む公衆衛生介入の延長が支持される可能性がある。抗体媒介性免疫の持続期間を決定するためには、より症候性および無症候性の個人をプロファイリングする追加の縦断的血清学的研究が緊急に必要である。加えて、血清陰性になる可能性が高い無症候性患者における低レベルの抗ウイルスIgGは、真の感染率を研究するためのタイムリーな血清サーベイランスの必要性をさらに支持する。
方法
試験デザインおよび参加者
2020年1月21日から2月19日の間に、武漢市または湖北省から帰国した25例の輸入症候性患者(和州地区登録)が、和州地区のRT-PCR検査陽性に基づいてSARS-CoV-2感染で確認された。(南州は、湖北省に隣接する地方レベルの自治体である重陽市の中で最も被災しやすい地域である。)2020年4月10日までに、確定患者の密接な接触者や武漢から帰国した人を含む計2088人が、地域のCDCによる隔離のもとに置かれ、RT-PCR法により検査された。この2088名のうち、93名が症状を発現し、SARS-CoV-2陽性であった。
2020年2月6日、中国のNational Health Commission of Chinaは、密接な接触者の管理に関するCOVID-19予防・制御計画(第4版)を更新し、無症候性の個人の同定と隔離を重視した。その後、地域のCDCは、隔離された個々の広範なRT-PCRスクリーニングを実施した。症例がRT-PCR法で陽性と確認されたら、地域のCDCスタッフが最初の有病率調査を実施した。COVID-19を有することが確認された個人には、人口統計学的特性(出生、性別および腎疾患のデータ)、既存の病態(高血圧、糖尿病、心血管疾患、脳血管疾患、慢性肺疾患、腎疾患、慢性肝疾患、慢性肝障害および免疫不全疾患の既往を含む)および症状、ならびに先行する14日間のスクリーニング記録(発熱、咳嗽、喀痰、息切れ、悪寒、筋肉痛、咽頭痛、鼻水、胸内苦悶、頭痛、下痢、嘔吐および悪心を含む)を含む情報を提供するよう求めた。COVID-19 Prevention and Control Plan (第4版)によれば、予備的スクリーニングに基づく無症候性の60人が特定され、中央隔離のために政府指定病院に転院した。入院時、無症候性の主張を裏付けるために、臨床医が1対1の面接を実施した。このスクリーニング後、17人が軽度または非定型症状のために除外された。臨床医は、個人が入院したら毎日症状スクリーニングを行う。入院から4~17日後に、これら43人の以前は無症状であった個人のうち6人が症状を発症し、症候性と再分類された。最後に、無症候性感染者37名に本試験について説明し、本試験に組み入れることに同意した。
無症候性感染を呈する個人が、中国におけるSARS-CoV-2流行の初期段階で臨床疾患に進行する可能性があるかどうかは不明であった。そこで、中国の臨床医は、2020年2月8日に発表された中国国立衛生研究所のCOVID-19治療ガイドライン(第5版)に従い、増悪の可能性を回避するために、インターフェロンα(IFN-α)吸入、抗ウイルス治療(リバビリン経口投与)および支持療法(チモペンチンや漢方薬などの免疫を強化する治療)を投与することを選択した。無症候性感染症の隔離と治療戦略は、各国の公式ガイドラインに従って更新すべきである。
次に、無症候性患者との比較のために、性別、年齢頻度および併存疾患をマッチさせた症候性患者37例を選択した(補足表1)。SARS-CoV-2のRT-PCR結果が陰性であった37人の性別および年齢頻度をマッチさせた対照も本研究に含めた。肺疾患、肝疾患、腎疾患、心血管疾患、代謝疾患または免疫不全疾患を有する患者は除外した。
データ収集
疫学的、人口統計学的、接触歴および曝露歴、臨床像、胸部CT、臨床検査、治療および転帰データを入院患者の診療記録から収集した。各患者について収集した臨床試験データは、全血球数、凝固プロファイル、血清生化学試験(腎機能および肝機能、電解質、乳酸脱水素酵素およびクレアチンキナーゼを含む)、血清フェリチンおよび感染のバイオマーカーを含んだ。すべての入院患者に対して胸部CTスキャンを実施した。
SARS-CoV-2感染を同定するために、鼻咽頭スワブを少なくとも2回採取し、RT-PCR法で検査した。全サンプルからのRNAは24時間以内に分離された。ウイルスRNAサンプルは、自動磁気ビーズ精製手順に基づいたNucleotide Acid Extraction Kit (DAAN Gene、登録番号20170583)を用いて製造業者の指示に従って抽出した。市販のRT-PCRキット(DAAN Gene、登録番号20203400063)を用いて、SARS-CoV-2のサンプルを検査した。簡単に述べると、オープンリーディングフレーム1ab (ORF1ab)およびヌクレオカプシドタンパク(N)を含む2つの標的遺伝子を同時に増幅し、RT‐PCR中に試験した。SARS-CoV-2に対するRT-PCR検査のプライマーは、Chinese CDCの推奨(ORF1ab forward: CCCTGTGGGTTTTACACTTAA、ORF1ab reverse: ACGATTGTGCATCAGCT GA、ORF1abプローブ:5′-CCGTCTGCGGTATGTGGAAAGGTTATGG-3′(FAM色素標識); N forward: GGGGAACTTCTCCTGCTAGAAT、N reverse: CAGACATT)に従った。
TTGCTCTCAAGCTG、Nプローブ:5′-TTGCTGCTGCTTGACAGATT-3′ (VIC色素標識))PCRサイクル: 50 °C 15分間、95 °C 15分間、94 °C 15秒間を含む45サイクル、55 °C 45秒間(蛍光収集)。
Ct値が37未満、40以上を両遺伝子それぞれ陽性、陰性と定義した。Ct値が37~40のサンプルは結論が出ないと定義し、2回目の検査が必要であった。入院1週間後から、入院期間の残りの期間は2~3日ごとに鼻咽腔検体をRT-PCR法で検査した。RT-PCRの結果が1件陽性であった患者をSARS-CoV-2感染患者と定義した。連続して2回のRT-PCRの結果が陰性であった患者をSARS-CoV-2陰性と定義した。
定義
検査室ベースのPCRを用いて、SARS-CoV-2陽性の鼻咽腔スワブを有する個人としてCOVID-19の確認症例を定義した。症候性患者は、発熱、咳、咽頭痛および痰などの症状を有する検査室で確認されたCOVID-19の患者と定義した。無症候性の症例は、核酸検査結果が陽性であったが、14日前および入院中に関連する臨床症状が認められなかった個人と定義した。密接な接触とは、(1)SARS-CoV-2に感染した人の約6フィート(2メートル)以内で10分以上経過した人、(2)COVID-19患者の感染性分泌物に直接接触した人と定義した。COVID-19患者と医療待合区域または病室を介護している間、同居している間、訪問している間、または共有している間に、密接な接触が起こりうる。排泄期間は、RT-PCR検査に基づいて、最初の陽性鼻咽腔サンプリングから最後の陽性サンプリングまでの日数として算出した。最後の陽性検体に続いて、2回の連続試験でRT-PCR陰性の結果が得られた。
SARS-CoV-2に対するIgGおよびIgMの検出
SARS-CoV-2に対するIgGおよびIgMは、製造者の指示に従い、磁気化学発光酵素免疫測定キット(Bioscience社)を用いて血漿サンプルから検出された。簡潔には、核タンパクおよびSARS−CoV−2のスパイクタンパク由来のペプチド(LQPELDSFKEELDKYFKNHTSPDVD)を含有する組換え抗原を、磁性粒子上に固定化した。
シュードウイルス中和アッセイを用いた中和検出
C末端19アミノ酸を欠くコドン最適化スパイク(S)を用いて、ルシフェラーゼ発現シュードウイルスを作製した。SARS−CoV−2シュードウイルス中和アッセイを、96ウェルプレートにおいてACE2を発現する293T細胞に対して行った。個体(鋭敏相からの1個のセラミック試料および同時期からの別のセラミック試料)から対になった希釈セラ(1:600)が得られ、等容量のSARS‐CoV‐2擬ビラスが添加され、プレートは37℃で1時間予備インキュベートされた。次いで、ACE2を発現する293T細胞を、100μlの血清−シュードウイルス混合物と共に24時間インキュベートした。感染3日後、細胞を30μlの溶解緩衝液(Promega)で溶解し、シュードウイルス形質導入を測定した。ルシフェラーゼ活性の相対ルミネセンス単位を、製造者の指示に従って、ルシフェラーゼアッセイキット(Promega)を用いて検出した。実験を2回繰り返した。ルシフェラーゼ活性は、GloMax Microplate Luminometer (Promega)によって測定した。中和率(%)は以下のように算出した:
NeutralizationRate(%)=RLUpesudovirus−RLUpesudoviruswithserumRLUpesudovirus−RLUblank100%NeutralizationRate(%)=RLUpesudovirus−RLUpesudoviruswithserumRLUpesudovirus−RLUblank100%
サイトカイン測定
臨床検査でSARS-CoV-2感染が確認された患者(無症候性群n = 37および症候性群n = 37)の血清を、入院中できるだけ早期に採取した。健常者(n = 37)の血清を対照群とした。48のサイトカインおよびケモカインの濃度は、製造者の指示に従い、Luminex 200(Luminex Multiplexing Instrument, Merck Millipore)上のBio-Plex Human Cytokine Screening Panel (48-Plex No. 12007283, Bio-Rad)を用いて測定した。48のサイトカインスクリーニングパネルには以下が含まれる:線維芽細胞増殖因子(FGF)、エオタキシン、顆粒球コロニー刺激因子(G-CSF)、インターフェロン-γ(IFN-γ)、インターロイキン-1β(IL-1RA)、インターロイキン1α(IL-1α)、インターロイキン-2受容体α(IL-2Rα)、インターロイキン-3(IL-3)、インターロイキン-12 p40(p40)インターロイキン-16(IL-16)、インターロイキン-4(IL-4)、インターロイキン-5(IL-6)、インターロイキン-7(IL-8)、インターロイキン-9(IL-9)、増殖調節がん遺伝子-α(GRO-α)、肝細胞増殖因子(HGF) インターフェロンα2(IFN-α2)、白血病抑制因子(LIF)、単球走化性タンパク3(MCP-3)、インターロイキン10(IL-10)、インターロイキン12 p70(p70)インターロイキン-13(IL-13)、インターロイキン-17A (IL-17A)、インターフェロンγ誘導性タンパク-1(IP-1)、γインターフェロン(MIG)によって誘導されるモノカイン、β-神経成長因子(SCF)、幹細胞成長因子-β(SCGF-β)、間質細胞由来因子1(SDF-1α)、マクロファージ炎症性タンパク-1β(MIP-1β)、血小板由来成長因子-BB (PDGF-BB)は、活性化時に調節され、正常なT細胞が発現し、おそらく分泌される(RANTES)), 腫瘍壊死因子α(TNF-α)、血管内皮増殖因子(VEGF)、皮膚T細胞誘引ケモカイン(CTACK)、マクロファージ遊走阻止因子(MIF)、TNF関連アポトーシス誘導リガンド(TRAIL)、インターロイキン18(IL-18)、マクロファージコロニー刺激因子(M-CSF)および腫瘍壊死因子β(TNF-β)。
統計解析
連続した特性はすべて中央値(IQR)として記載され、カテゴリー特性は数字(%)として記載される。無症候性と症候性および無症候性と健常対照群間の連続特性の有意差を、Mann‐Whitney U検定により決定した。カテゴリー特性の比較はフィッシャーの直接確率検定で行った。P値のカットオフ値は、抗体で0.05、サイトカインで0.001であり、有意性が示された。Kaplan-Meier法を用いて、症候性群および無症候性群におけるウイルス排泄期間を分析した。統計解析はRソフトウェア(version 3.6.0)を用いて行った。
倫理的承認
なお、本研究は重慶医科大学倫理委員会の承認を得た(参考文献番号2020004)。本試験に参加するための書面によるインフォームドコンセントは、本試験に登録された小児の代わりに成人参加者または保護者全員から得た。
***********
いかがでしたか?
無症候性またはほとんど症状がないかるいCOVID-19患者は抗体価も低く、抗体ができても消えるのが8週間と速い、ということですよね。
同じことを示す別の研究もあるので、無視できないインパクトがあります。
そうすると、ワクチンを開発しても全然意味がないってことになるのかな?
それとも、3か月ごとに打つとかするのかな?
まだまだ不明な点が多いですね。
大阪府の吉村知事が、ワクチンの治験で自分が被験者になる、と言っていますが。
こういう不利益もちゃんと説明できる体制で治験が行われるのかについて
大変疑問に感じます。
あと。知事は大阪市立大学で医療従事者を対象に治験すると言っていますが
知事がやるからと
断れない雰囲気を作るのだとしたら
ヘルシンキ宣言に違反する重大な事態となります。
もうちょっと医療に関する知識をもって発言なさったほうがよろしいかと存じます。


コメント